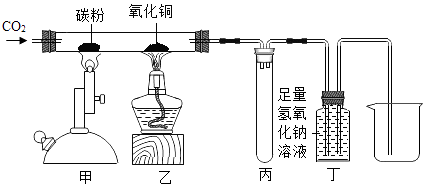
题目内容
【题目】化学就在我们身边,生活中蕴藏着丰富的化学知识.
(1)目前,人类以化石燃料为主要能源,化石燃料有煤、和天然气.
(2)液态二氧化碳灭火器可用于扑灭档案室发生的火灾,下列说法正确的(填序号).
A.液态二氧化碳气化后不会污染档案资料
B.二氧化碳可覆盖在燃烧物表面,隔绝空气
C.液态二氧化碳气化时吸热,降低了可燃物着火点
(3)氯化钠(NaCl) 和硝酸钾 (KNO3) 在不同温度时的溶解度及其溶解度曲线如图1:
温度(℃) | 10 | 20 | 40 | 60 | 80 |
KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
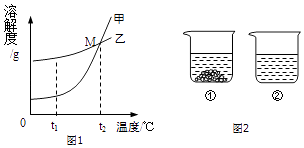
①图中能表示KNO3溶解度曲线的是(填“甲”或“乙”).
②t1oC时,等质量的甲和乙二种物质分别加水制成相应的饱和溶液,得到溶液质量较大的是 . (填“甲”或“乙”)
③20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g水,充分溶解后,恢复至20℃,其结果如图2所示.下列有关说法中,正确的有 . (填字母编号)
A.烧杯①中溶解的是KNO3 , 烧杯②中溶解的是NaCl
B.烧杯②中溶液一定是不饱和溶液
C.升高温度或增加溶剂都有可能将烧杯①中固体全部溶解
D.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数一定减小
(4)亚硝酸钠(NaNO2)是一种常用的防腐剂.结合图3“小资料”回答问题: 
①根据资料,小明设计如图的实验:
实验A中观察到的现象是 , 反应的化学方程式为 , 实验B观察到溶液最终变为色.
②亚硝酸钠加热分解放出有刺激性气味的气体,该气体可能是(填字母).
A.NO2 B.NH3 C.N2 D.SO2 .
【答案】
(1)石油
(2)AB
(3)甲;甲;AC
(4)铁粉逐渐消失,有气泡冒出,溶液变为浅绿色;Fe+2HCl=FeCl2+H2↑;黄;A
【解析】解:(1)化石燃料主要有煤、石油和天然气;(2)液态二氧化碳汽化吸热,可以降低可燃物的温度,覆盖在可燃物表面隔绝空气,故选:AB;(3)①通过分析溶解度表中的数据可知,硝酸钾的溶解度受温度变化影响较大,所以图中能表示KNO3溶解度曲线的是甲;②t1oC时,甲物质的溶解度小于乙物质的溶解度,所以等质量的甲和乙二种物质分别加水制成相应的饱和溶液,得到溶液质量较大的是甲;③20℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g水,充分溶解后,恢复至20℃,其结果如图2所示,20℃时,硝酸钾的溶解度小于氯化钠的溶解度,所以 A.烧杯①中溶解的是KNO3 , 烧杯②中溶解的是NaCl,故A正确;B.烧杯②中溶液可能是不饱和溶液,故B错误;C.硝酸钾的溶解度随温度的升高而增大,所以升高温度或增加溶剂都有可能将烧杯①中固体全部溶解,故C正确;D.若将烧杯①中的溶液变为不饱和溶液,溶液的溶质质量分数可能不变,故D错误.
故选:AC;(4)①铁和盐酸反应生成氯化亚铁和氢气,所以实验A中观察到的现象是铁粉逐渐消失,有气泡冒出,溶液变为浅绿色,化学方程式为:Fe+2HCl=FeCl2+H2↑,亚硝酸钠可以将亚铁离子转化成铁离子,所以实验B观察到溶液最终变为黄色;②亚硝酸钠加热分解放出有刺激性气味的气体,化学反应前后,原子种类不变,所以不会生成氨气和二氧化硫,氮气无味,故选A.
所以答案是:(1)石油;(2)AB;(3)①甲;②甲;③AC;(4)①铁粉逐渐消失,有气泡冒出,溶液变为浅绿色,Fe+2HCl=FeCl2+H2↑,黄;②A.
【考点精析】本题主要考查了饱和溶液和不饱和溶液和饱和溶液和不饱和溶液相互转变的方法的相关知识点,需要掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解;饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂才能正确解答此题.

 优等生题库系列答案
优等生题库系列答案【题目】如图,一木块漂浮于X中,向X中缓缓加入(或通入)少量物质Y后最终木块上浮,则X与Y可能是(溶液的体积变化忽略不计)( )
序号 | X | Y |
① | 水 | 酒精 |
② | 氢氧化钙溶液 | 二氧化碳 |
③ | 稀硫酸 | 镁粉 |
④ | 硫酸铜溶液 | 锌粉 |

A.①②④
B.③④
C.①②③
D.②③④
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中 继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是 , 白色物质可能是或 , 乙同学还认为白色物质是氢氧化钠.
甲同学立刻认为乙同学的猜想是错误的,其理由是
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O═2NaOH
【实验探究】甲同学对白色物质进行实验探究.
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质 |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,其理由是
【得出结论】钠在二氧化碳中燃烧的化学方程式为 .