��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ�ⶨͭ��Ũ���ᷴӦ�������Һ������������������������������ʵ�鷽���� 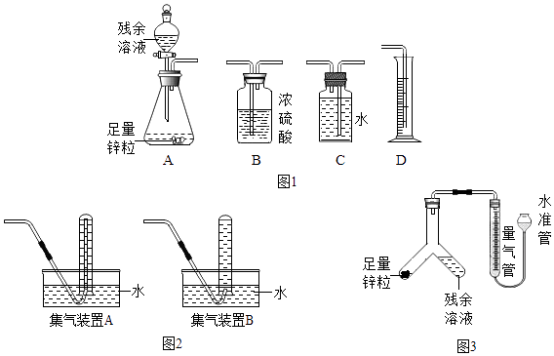
���������ϡ�Cu+2H2SO4��Ũ�� ![]() Cu SO4+SO2+2H2O
Cu SO4+SO2+2H2O
��ʵ����ơ���������������Һ������BaCl2��Һ��Ӧ���������ɵ�BaSO4������
�ҷ�������������Һ������п����Ӧ���������������������
������������
��1��ͭ��Ũ���ᷴӦ�м�ʹͭ����Ҳ���ܽ�������ȫ��Ӧ��ԭ������
��2�������Ƿ���У�������С������С�������������
��3����ʵ��̽���� С��ͬѧѡ��ͼ2�еIJ���ʵ��װ�ý������ҷ�����ʵ�飺
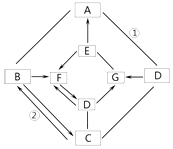
������Ϊͼ1�������װ�ü�������˳���ǣ���
��ʵ�鿪ʼʱ���ȴ�Һ©���ϿڵIJ�����������������������һ����������Һ
�Ͳ���˳��������ƿ����ԭ������
��ijѧ��������ˮ���ռ������������䴿�ȣ�Ӧѡ��ͼ2�еļ���װ�����A����B������
��4��С��ͬѧ����ͼ3��ʾװ�ý������ҷ�����ʵ�飺 ����������������װ�������ԣ�������˵��װ�����������õ���������ţ���
A��������������ˮ����עˮ��ֱ���������߹����γ��ȶ��߶Ȳ
B����ˮ����עˮ�����Ӻ����װ�ã�̧��ˮ�ܣ���������Һ��ʼ����ƽ��
��ʵ���в�����Һ��п����Ϻ��������п�����ܽ⡢
�����������ݣ��ų�������
�۷�Ӧ��Ϻ�ÿ���1���Ӷ�ȡ������������������С��ֱ��������䣮���������С��ԭ����
���ų�������ʵ�������Ӱ�����أ���
����ʵ���в�ò�����Һ�������������������ƫ�����п��ܵ�ԭ���� ��
a��װ��©��
b����ȡ����ʱˮ�ܵ�ˮ����������ܵ�ˮ��
c��δ����ȴ�Ͷ�ȡ�����ܶ�����
���𰸡�
��1�����ŷ�Ӧ�Ľ��У�Ũ����Ũ���½����ϡ���ᣬ��ͭ��ϡ�����Ӧ
��2�������У�������Һ�е�����ͭҲ�ܺ��Ȼ�����Ӧ�������ᱵ����
��3��A��C��D����Ӧ�����������壬ʹƿ��ѹǿ����B
��4��A�����ɺ�ɫ���壬��Һ������ɫ�����ɫ����������ȴ�����������С��C
���������⣺��1��ͭ��Ũ���ᷴӦ�м�ʹͭ����Ҳ���ܽ�������ȫ��Ӧ��ԭ���ǣ����ŷ�Ӧ�Ľ��У�Ũ����Ũ���½����ϡ���ᣬ��ͭ��ϡ�����Ӧ�� ������ŷ�Ӧ�Ľ��У�Ũ����Ũ���½����ϡ���ᣬ��ͭ��ϡ�����Ӧ����2�����������У�������Ϊ������Һ�е�����ͭҲ�ܺ��Ȼ�����Ӧ�������ᱵ������
��������У�������Һ�е�����ͭҲ�ܺ��Ȼ�����Ӧ�������ᱵ��������3����ͼ1�������װ�ü�������˳����A��C��D��A�в�������������C�У�C������D�е�ˮ�������Ϊ��Ӧ�����������������A��C��D����ʵ�鿪ʼʱ���ȴ�Һ©���ϿڵIJ�����������������������һ����������Һ�Ͳ���˳��������ƿ����ԭ���Ƿ�Ӧ�����������壬ʹƿ��ѹǿ����
�����Ӧ�����������壬ʹƿ��ѹǿ����ijѧ��������ˮ���ռ������������䴿�ȣ�Ӧѡ��ͼ2�еļ���װ��B����ѡ��B����4����A��������������ˮ����עˮ��ֱ���������߹����γ��ȶ��߶Ȳ˵��װ�ò�©����B����ˮ����עˮ�����Ӻ����װ�ã�̧��ˮ�ܣ���������Һ��ʼ����ƽ��˵��װ��©������ѡ��A����ʵ���в�����Һ��п����Ϻ�п��ϡ���ᷴӦ��������п��������������ͭ��Ӧ��������п��ͭ�������е�������п�����ܽ⡢���ɺ�ɫ���塢��Һ������ɫ�����ɫ�������������ݣ��ų�������
������ɺ�ɫ���壬��Һ������ɫ�����ɫ���۷�Ӧ��Ϻ����������С��ԭ������������ȴ�����������С�������������ȴ�����������С����a��װ��©��ʱ���ᵼ���ռ�������ƫ�٣��Ӷ����¼�����������������������ƫС��b����ȡ����ʱˮ�ܵ�ˮ����������ܵ�ˮ�棬�����������ƫС���Ӷ����¼�����������������������ƫС��c��δ����ȴ�Ͷ�ȡ�����ܶ����������������ƫ�Ӷ����¼�����������������������ƫ��
��ѡ��c��
�����㾫����������Ҫ��������������ȡ�ͼ�������֪ʶ�㣬��Ҫ����������ʵ�����Ʒ�ԭ����Zn + H2SO4 = ZnSO4 +H2����Zn + 2HCl = ZnCl2 +H2��������Ũ�����ԭ�� Ũ������ǿ�ӷ��� ��������Ũ����������ԭ�� Ũ�����������ǿ�����Բ�����ȷ�����⣮

����Ŀ���±������к����������ʣ����г��ӷ�����ȷ����
���� | ���� | ��ȥ���ʵķ��� | |
A | CaCl2��Һ | HCl | ����̼������Һ |
B | CO2 | O2 | ͨ�����ȵ�ͭ�� |
C | NaOH | Na2CO3 | ����ϡ���������ٲ������� |
D | CuO | Cu | ������ϡ���ᣬ��ֽ�����ٹ��� |
A. A B. B C. C D. D
����Ŀ��������ͼװ����ɵ�ʵ���ǣ� ��
| A | B | C | D | |
���� | ������̼ | ���� | һ����̼��������̼ | �Ȼ��� | |
Һ�� | ����������Һ | ˮ | ����������Һ | ��̪��Һ | |
ʵ�� | ���������̼ | ����������� | ��ȥһ����̼ | ֤����������ˮ������ |
A.A
B.B
C.C
D.D
����Ŀ����ѧ�����������ߣ��������̲��ŷḻ�Ļ�ѧ֪ʶ��
��1��Ŀǰ�������Ի�ʯȼ��Ϊ��Ҫ��Դ����ʯȼ����ú������Ȼ����
��2��Һ̬������̼����������������ҷ����Ļ��֣�����˵����ȷ��������ţ���
A.Һ̬������̼��������Ⱦ��������
B.������̼�ɸ�����ȼ������棬��������
C.Һ̬������̼����ʱ���ȣ������˿�ȼ���Ż��
��3���Ȼ��ƣ�NaCl�� ������� ��KNO3�� �ڲ�ͬ�¶�ʱ���ܽ�ȼ����ܽ��������ͼ1��
�¶ȣ��棩 | 10 | 20 | 40 | 60 | 80 |
KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
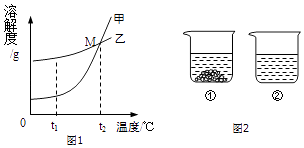
��ͼ���ܱ�ʾKNO3�ܽ�����ߵ�������ס����ҡ�����
��t1oCʱ���������ļ��Ҷ������ʷֱ��ˮ�Ƴ���Ӧ�ı�����Һ���õ���Һ�����ϴ���� �� ����ס����ҡ���
��20��ʱ���������ֱ�ʢ����ͬ����������غ��Ȼ��Ƶ��ձ��У�������100gˮ������ܽ�ָ���20�棬������ͼ2��ʾ�������й�˵���У���ȷ���� �� ������ĸ��ţ�
A���ձ������ܽ����KNO3 �� �ձ������ܽ����NaCl
B���ձ�������Һһ���Dz�������Һ
C�������¶Ȼ������ܼ����п��ܽ��ձ����й���ȫ���ܽ�
D�������ձ����е���Һ��Ϊ��������Һ����Һ��������������һ����С
��4���������ƣ�NaNO2����һ�ֳ��õķ����������ͼ3��С���ϡ��ش����⣺ 
�ٸ������ϣ�С�������ͼ��ʵ�飺
ʵ��A�й۲쵽�������� �� ��Ӧ�Ļ�ѧ����ʽΪ �� ʵ��B�۲쵽��Һ���ձ�Ϊɫ��
���������Ƽ��ȷֽ�ų��д̼�����ζ�����壬�����������������ĸ����
A��NO2 B��NH3 C��N2 D��SO2 ��