��Ŀ����
����Ŀ��ij��ѧ��ȤС����λͬѧ��ѧϰ��ϡ�������������Ʒ�Ӧ����Լ�������ʵ�飬�ֱ�Ӳ�ͬ����������ͼ��������A��ʵ�ʲ���ͼ��B�Ƿ�Ӧ��������Һ�����ȱ仯ͼ��C�������ӽ�Ϲ��̵�ʾ��ͼ�� 
��1���ñ仯��Ӧ��ʵ������ǽ��μӵ���һ����Һ�У�
��2����������Һ����Ϊagʱ����Һ�е�����Ϊ���ѧʽ����
��3������Һ��PH=7ʱ����Һ�е���Ҫ�������������ӷ��ţ���
��4����������Һ����Ϊbgʱ����������Һ�еμ���ɫʯ����Һ����Һ��ɫ��
��5���ӷ�Ӧǰ�����ӵ��������Щ���Ӳ����˷�Ӧ����Щ����ֻ���Թ��ߣ��÷�Ӧ�в��뷴Ӧ�������� ��
��6��ʵ����ʹ�õ�����������Һ������40g��������������10%����Ӧ��������ҺPHΪ7ʱ������ϡ�����������40g��������ϡ������������������Ƕ��٣�
���𰸡�
��1��ϡ����
��2��NaCl��NaOH
��3��Na+��Cl-
��4����
��5��H+��OH
��6���⣺��HCl������Ϊx���������Ƶ�����Ϊ40g��10%=4g
NaOH+ | HCl=NaCl+H2O |
40 | 36.5 |
4g | x |
![]()
x=3.65g
ʵ��������ϡ���������ʵ����������� ![]() 100%=9.125%
100%=9.125%
�𰸣�ʵ��������ϡ���������ʵ�����������9.125%
���������⣺��1�������pH�仯���ɴ���7��С��7�Ĺ��ɣ���˽��еIJ����ǽ�ϡ����μӵ�����������Һ�У����ϡ�����2����������Һ������Ϊagʱ����Һ���ּ��ԣ�������Һ�е�����Ϊ�������ƺ��Ȼ��ƣ����NaCl��NaOH����3������Һ��pH=7ʱ�����ǡ����ȫ��Ӧ����Һ�е���Ҫ�����������Ӻ������ӣ�Na+��Cl������4����������Һ������Ϊbgʱ��������Һ�����ԣ�������Һ�е�����Ϊ�Ȼ�����Ȼ��ƣ���������Һ�еμ���ɫʯ����Һ����Һ�ʺ�ɫ���죻��5���кͷ�Ӧ��ʵ���������������Ӻͼ������������������������ˮ�Ĺ��̣����кͷ�Ӧ��ʵ����H++OH��=H2O��H+��OH�� ��
�����㾫���������кͷ�Ӧ����Ӧ�ú���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�кͷ�Ӧ����������������κ�ˮ�ķ�Ӧ��ע�⣺a����ƽ b������ c�����ţ�

 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д�����Ŀ����ѧ�����������ߣ��������̲��ŷḻ�Ļ�ѧ֪ʶ��
��1��Ŀǰ�������Ի�ʯȼ��Ϊ��Ҫ��Դ����ʯȼ����ú������Ȼ����
��2��Һ̬������̼����������������ҷ����Ļ��֣�����˵����ȷ��������ţ���
A.Һ̬������̼��������Ⱦ��������
B.������̼�ɸ�����ȼ������棬��������
C.Һ̬������̼����ʱ���ȣ������˿�ȼ���Ż��
��3���Ȼ��ƣ�NaCl�� ������� ��KNO3�� �ڲ�ͬ�¶�ʱ���ܽ�ȼ����ܽ��������ͼ1��
�¶ȣ��棩 | 10 | 20 | 40 | 60 | 80 |
KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
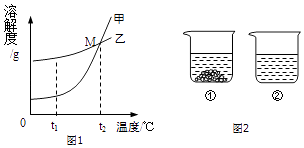
��ͼ���ܱ�ʾKNO3�ܽ�����ߵ�������ס����ҡ�����
��t1oCʱ���������ļ��Ҷ������ʷֱ��ˮ�Ƴ���Ӧ�ı�����Һ���õ���Һ�����ϴ���� �� ����ס����ҡ���
��20��ʱ���������ֱ�ʢ����ͬ����������غ��Ȼ��Ƶ��ձ��У�������100gˮ������ܽ�ָ���20�棬������ͼ2��ʾ�������й�˵���У���ȷ���� �� ������ĸ��ţ�
A���ձ������ܽ����KNO3 �� �ձ������ܽ����NaCl
B���ձ�������Һһ���Dz�������Һ
C�������¶Ȼ������ܼ����п��ܽ��ձ����й���ȫ���ܽ�
D�������ձ����е���Һ��Ϊ��������Һ����Һ��������������һ����С
��4���������ƣ�NaNO2����һ�ֳ��õķ����������ͼ3��С���ϡ��ش����⣺ 
�ٸ������ϣ�С�������ͼ��ʵ�飺
ʵ��A�й۲쵽�������� �� ��Ӧ�Ļ�ѧ����ʽΪ �� ʵ��B�۲쵽��Һ���ձ�Ϊɫ��
���������Ƽ��ȷֽ�ų��д̼�����ζ�����壬�����������������ĸ����
A��NO2 B��NH3 C��N2 D��SO2 ��


