题目内容
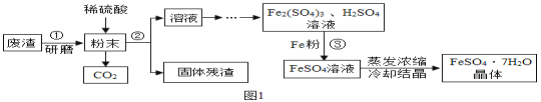
【题目】我国海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大.Ⅰ.我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的方法主要为“盐田法”,生产流程如下:
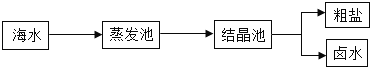
(1)在蒸发池中促进水分蒸发,主要是利用了下列各项中的 (填选项序号).
①潮汐能 ②生物能 ③电能 ④太阳能 ⑤化学能
(2)上述流程中得到的卤水是氯化钠的 溶液(填“饱和”或“不饱和”).
Ⅱ.金属镁广泛应用于生活、生产和国防工业.从卤水中提取镁的过程所示:
![]()
在上述转化过程中,①处操作的名称是 ,在进行该项操作时用到的玻璃仪器是 ;②处发生的化学方程式是 ;上述流程中没有涉及到的基本反应类型是 .
Ⅲ.氨碱法制纯碱的工业流程如下:
![]()
(1)最终所得纯碱主要成分的化学式是 ,该产品易溶于水,溶液显 性;
(2)由步骤③所得的碳酸氢钠在生产和生活中有许多重要用途,在食品工业上,它是 的主要成分;
(3)试写出步骤③中发生反应的化学方程式 .
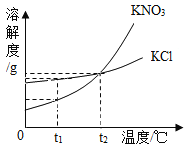
Ⅳ.海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素.KCl和KNO3的溶解度曲线如图所,试回答下列问题:
(1)t1℃时,KCl饱和溶液的溶质质量分数 KNO3饱和溶液的溶质质量分数(填“大于”“小于”“等于”之一).
(2)已知20℃时,KNO3的溶解度为31.6g;80℃时,KNO3的溶解度为169g.在20℃时,向盛有200g水的烧杯中加入80g硝酸钾,充分溶解,得到该温度时KNO3的 (填“饱和”“不饱和”之一)溶液,若使烧杯内物质缓慢升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为 (填最简整数比)
【答案】Ⅰ.(1)④;(2)饱和.Ⅱ.过滤,漏斗、烧杯、玻璃棒,2HCl+Mg(OH)2═MgCl2+2H2O,化合反应、置换反应.Ⅲ.(1)Na2CO3,碱;(2)发酵粉;(3)NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl.Ⅳ.(1)大于;饱和,2:5.
【解析】Ⅰ.(1)在蒸发池中促进水分蒸发,主要是利用了太阳能,
(2)卤水是氯化钠的饱和溶液
Ⅱ.在上述转化过程中,①处操作得到的是氢氧化镁固体,该操作的名称是过滤,在进行该项操作时用到的玻璃仪器是漏斗、烧杯、玻璃棒;②处是盐酸和氢氧化镁反应生成氯化镁和水,发生的化学方程式是2HCl+Mg(OH)2═MgCl2+2H2O;上述流程中没有涉及到的基本反应类型是化合反应、置换反应,
Ⅲ.(1)最终所得纯碱主要成分是碳酸钠,其化学式是Na2CO3,该产品易溶于水,溶液显碱性,
(2)由步骤③所得的碳酸氢钠在食品工业上是发酵粉的主要成分
(3)步骤③中是氨气、氯化钠、水和二氧化碳反应生成了碳酸氢钠和氯化铵,发生反应的化学方程式NH3 + NaCl + H2O + CO2 = NaHCO3 + NH4Cl,
Ⅳ.(1)t1℃时,氯化钾的溶解度大于硝酸钾的溶解,故KCl饱和溶液的溶质质量分数大于KNO3饱和溶液的溶质质量分数,
(2)在20℃时,向盛有200g水的烧杯中加入80g,充分溶解,得到该温度时KNO3的饱和溶液,若使烧杯内物质缓慢升温至80℃,在该温度下,最后所得溶液中溶质与溶剂的质量之比为80:200=2:5,

 综合自测系列答案
综合自测系列答案