题目内容
【题目】FeSO47H2O是一种重要的食品和饲料添加剂。某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(SiO2既不溶于水也不溶于稀硫酸)。实验室用此废渣制备FeSO47H2O的流程如图1:
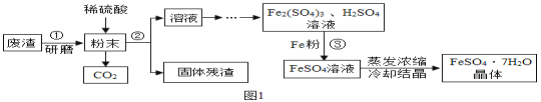
请根据流程图回答下列问题:
(1)步骤①研磨的目的是 。
(2)操作②的名称是 ,所需要的玻璃仪器是:烧杯、玻璃棒和 。
(3)经测定,固体残渣中只含有CaSO4和SiO2,你认为实验室 (填“能”或者“不能”)用粉末状的石灰石与稀硫酸反应制二氧化碳。
(4)写出③中发生的化学反应方程式 、 。
(5)已知硫酸亚铁的溶解度和析出晶体的组成如下表:
温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
析出晶体 | FeSO47H2O | FeSO44H2O | FeSO4H2O | |||||||
根据上表,硫酸亚铁晶体(FeSO47H2O)冷却结晶温度最高不超过 ;待结晶完毕后,滤出晶体,用少量冰水洗涤2﹣3次。用冰水洗涤的目的是:Ⅰ除去晶体表面附着的杂质;Ⅱ 。
【答案】(1)增大接触面积,充分反应(意思相近也给分)
(2)过滤,漏斗 (3)能
(4)Fe + H2SO4 =FeSO4 + H2↑、Fe+Fe2(SO4)3=3FeSO4
(5)64℃ (6)减少晶体损耗
【解析】
试题分析:(1)研磨使固体颗粒变小,可增大表面积;(2)分离固体和液体,为过滤;(3)颗粒足够小,即使生成的微溶与水的硫酸钙也不能阻碍反应的继续进行,可以;(4)由图可知为Fe和 H2SO4 的反应及Fe和Fe2(SO4)3的反应;(5)由表,温度>64℃,析出的晶体就不再是FeSO47H2O;(6)水洗涤除去杂质,冰水温度低可极大避免晶体的溶解。

 阅读快车系列答案
阅读快车系列答案【题目】小刚用pH试纸测得家庭常用洗涤剂的pH如下表所示:
物质 | 厕所清洁剂 | 洗发精 | 洗衣液 | 厨房清洁剂 |
pH | 1 | 8 | 10 | 13 |
在没有除锈剂的情况下,可以用来替代除锈剂的是( )
A.厕所清洁剂 B.洗发精 C.洗衣液 D.厨房清洁剂