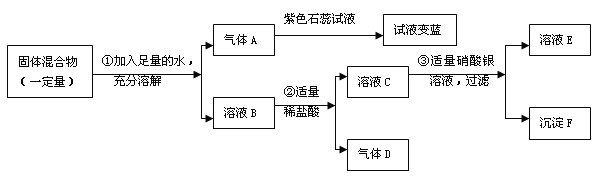
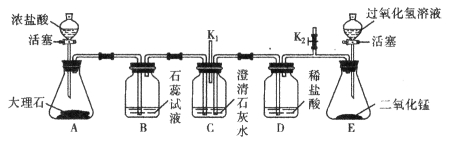
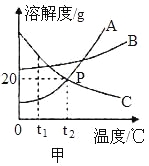
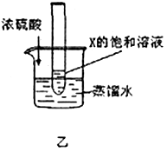
题目内容
【题目】将6.8 g含杂质的锌粒,加入到盛有50.0g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算
⑴生成氢气的质量 。
⑵锌粒中所含锌的质量分数(精确到0.1%)。(Zn-65 H-1)
【答案】(1)0.2 g (2)95.6%
【解析】
试题分析:根据质量守恒定律化学反应前后物质的总质量不变,故减少的质量为生成的氢气的质量。利用化学方程式,利用氢气与锌反应的质量比即可求出锌的质量。
解:(1) 生成氢气的质量=6.8g+50g-56.6g=0.2g
(2)设锌粒中含锌的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
x 0.2g
![]()
解得x = 6.5 g
锌粒中锌的质量分数: ![]()
答:略

练习册系列答案
相关题目