题目内容
【题目】下列物质在pH=1的溶液中能大量共存,且溶液为无色的是( )
A. NH4Cl、Na2SO4、KNO3 B. NaCl、Na2CO3、Na2SO4
C. BaCl2、K2SO4、NaOH D. FeCl3、Ba(NO3)2、CaCl2
【答案】A
【解析】A、A中各物质间不发生化学反应,能共存;B碳酸钠在pH=1的溶液中反应生成新的盐和二氧化碳、水,不共存;C氯化钡和硫酸钾反应生成不溶于酸的沉淀硫酸钡而不共存;D氯化铁溶液为黄色;选A

 导学全程练创优训练系列答案
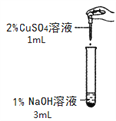
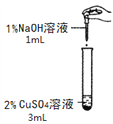
导学全程练创优训练系列答案【题目】在一次化学实验中,两组同学都完成了硫酸铜溶液与氢氧化钠溶液反应的实验,但观察到了不同的实验现象。
【实验一】
实验组 | 甲组 | 乙组 |
实验操作 |
|
|
实验现象 | 产生蓝色沉淀 | 产生蓝绿色沉淀 |
⑴已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式______。
【提出问题】乙组产生的蓝绿色沉淀的成分是什么呢?
【查阅资料】
Ⅰ.碱式硫酸铜是绿色晶体,在水中溶解度极小,能溶于稀酸溶液。
Ⅱ.碱式硫酸铜的组成不固定,一般可用Cu2(OH)2SO4表示。
【猜想与假设】蓝绿色沉淀是碱式硫酸铜。
【实验二】
实验步骤 | 主要实验操作 | 现象及结论 |
① | 取乙组实验后的混合物过滤 | 得到蓝绿色沉淀 |
② | 取蓝绿色沉淀,用蒸馏水洗涤多次 | 无明显现象 |
③ | 向最后一次洗涤液中滴加BaCl2溶液 | 无沉淀产生 |
④ | 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 | 沉淀全部溶解,得到蓝绿色溶液 |
⑤ | 取少量蓝绿色溶液于试管中,滴加试剂X | 产生白色沉淀 |
实验结论:蓝绿色沉淀是碱式硫酸铜 | ||
【解释与结论】
⑵步骤③的实验目的是______。
⑶步骤④中的稀盐酸______(选填“能”或“不能”)用稀硫酸代替。
⑷步骤⑤中滴加的试剂X是______。
【反思与评价】
⑸甲组同学在本组实验的基础上进一步成下列实验:
①过滤,取蓝色沉淀于试管中;
②滴加______,沉淀颜色变为蓝绿色;
③重复实验二中的步骤①~⑤。
经实验验证,氢氧化铜也可以转化为碱式硫酸铜。此反应的化学方程式为______。
⑹乙组同学认为在自己组原有实验的基础上,继续滴加______,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。
⑺为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是______。