题目内容
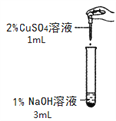
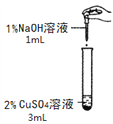
【题目】在一次化学实验中,两组同学都完成了硫酸铜溶液与氢氧化钠溶液反应的实验,但观察到了不同的实验现象。
【实验一】
实验组 | 甲组 | 乙组 |
实验操作 |
|
|
实验现象 | 产生蓝色沉淀 | 产生蓝绿色沉淀 |
⑴已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式______。
【提出问题】乙组产生的蓝绿色沉淀的成分是什么呢?
【查阅资料】
Ⅰ.碱式硫酸铜是绿色晶体,在水中溶解度极小,能溶于稀酸溶液。
Ⅱ.碱式硫酸铜的组成不固定,一般可用Cu2(OH)2SO4表示。
【猜想与假设】蓝绿色沉淀是碱式硫酸铜。
【实验二】
实验步骤 | 主要实验操作 | 现象及结论 |
① | 取乙组实验后的混合物过滤 | 得到蓝绿色沉淀 |
② | 取蓝绿色沉淀,用蒸馏水洗涤多次 | 无明显现象 |
③ | 向最后一次洗涤液中滴加BaCl2溶液 | 无沉淀产生 |
④ | 取洗涤后的蓝绿色沉淀于试管中,滴加稀盐酸 | 沉淀全部溶解,得到蓝绿色溶液 |
⑤ | 取少量蓝绿色溶液于试管中,滴加试剂X | 产生白色沉淀 |
实验结论:蓝绿色沉淀是碱式硫酸铜 | ||
【解释与结论】
⑵步骤③的实验目的是______。
⑶步骤④中的稀盐酸______(选填“能”或“不能”)用稀硫酸代替。
⑷步骤⑤中滴加的试剂X是______。
【反思与评价】
⑸甲组同学在本组实验的基础上进一步成下列实验:
①过滤,取蓝色沉淀于试管中;
②滴加______,沉淀颜色变为蓝绿色;
③重复实验二中的步骤①~⑤。
经实验验证,氢氧化铜也可以转化为碱式硫酸铜。此反应的化学方程式为______。
⑹乙组同学认为在自己组原有实验的基础上,继续滴加______,可以将碱式硫酸铜转变为氢氧化铜。通过实验,也验证了他们的猜想。
⑺为了确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是______。
【答案】 CuSO4 + 2NaOH = Na2SO4 +Cu(OH)2↓ 检验蓝绿色沉淀是否洗涤干净 不能 BaCl2溶液 CuSO4溶液 Cu(OH)2 + CuSO4 = Cu2(OH)2SO4 NaOH溶液 氢氧化钠溶液要足量(或过量)
【解析】(1). 硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜和硫酸钠,CuSO4 + 2NaOH = Na2SO4 +Cu(OH)2↓ (2). 硫酸钠和氯化钡反应生成硫酸钡沉淀,向最后一次洗涤液中滴加BaCl2溶液,无沉淀产生,说明蓝绿色沉淀已经洗涤干净 ; (3). 盐酸如果换成硫酸会与 BaCl2溶液 反应生成白色沉淀,干扰碱式硫酸铜是验证。 (5). 氢氧化铜和硫酸铜反应生成碱式硫酸铜,所以应滴加CuSO4溶液 ,反应方程式为Cu(OH)2 + CuSO4 = Cu2(OH)2SO4 (7). 由上述分析可知硫酸铜和氢氧化钠反应时,硫酸铜过量会生成碱式硫酸铜,,以此类推,氢氧化钠过量时易得到氢氧化铜,所以应滴加NaOH溶液 ,将蓝绿色沉淀转化为蓝色沉淀; 确保氢氧化钠溶液和硫酸铜溶液反应生成氢氧化铜,实验的关键是氢氧化钠溶液要足量(或过量)

【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体.但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体.
【提出问题】为什么会生成淡黄色固体?
【查阅资料】小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是 ;
【提出猜想】分析资料,小婧认为淡黄色固体可能是由镁与空气中的 反应生成的;
【实验探究】小婧设计实验证实了自己的猜想,她的方案可能 ;
【实验结论】根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式: 、
【反思与评价】通过上述实验,你对燃烧有什么新的认识? .