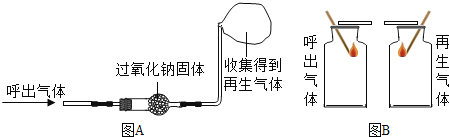
题目内容
【题目】如图是过氧化氢在一定条件下发生分解反应的微观模拟图,请回答下列问题:
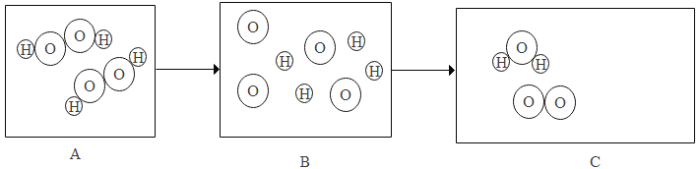
(1)在C图中将相关粒子图形补充完整_____(用“![]() ”表示氢原子,用“
”表示氢原子,用“![]() ”表示氧原子);
”表示氧原子);
(2)此化学变化中发生改变的粒子是_____。
(3)此反应中两种氧化物之间的质量的最简整数比为_____。
(4)画出比一个水分子质子数多两个的粒子的离子结构示意图_____。
【答案】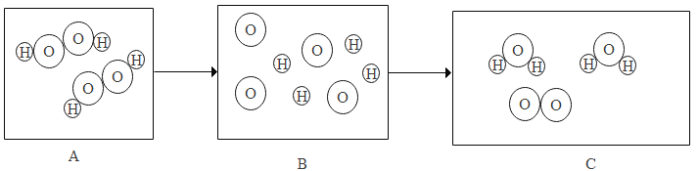 过氧化氢分子 17:9
过氧化氢分子 17:9 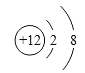
【解析】
(1)由质量守恒定律反应前后原子的种类及数目不变可知,在C图中分别补充一个氧分子和一个水分子,如下图:
 ;
;
(2)由微粒的变化可知,此化学变化中发生改变的粒子是过氧化氢分子;
(3)过氧化氢分解的方程式是:2H2O2 2H2O+O2↑,两种氧化物之间的质量的最简整数比为(34×2):(18×2)=17:9;
2H2O+O2↑,两种氧化物之间的质量的最简整数比为(34×2):(18×2)=17:9;
(4)由微粒的结构示意图可知,一个水分子有10质子,多两个质子的离子是镁离子,结构示意图为: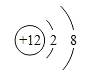 。
。

【题目】化学兴趣小组为验证质量守恒定律,他们在老师指导下,做了镁条在空气中燃烧的实验。
(1)写出镁条与氧气反应的化学方程式:_____。
(2)小华发现燃烧所得固体的质量大于消耗的镁条质量,他据此认为该反应不遵循质量守恒定律。你_____(同意”或“不同意”)小华的观点,理由是_____。
(3)小红按如图装置进行实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。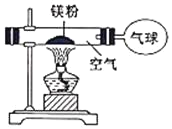
(提出问题)黄色固体是什么物质?
(查阅资料)①镁与氮气反应生成黄色的氮化镁(Mg3N2)固体;②氮化镁可与水剧烈反应产生氨气。
(做出猜想)黄色固体为氮化镁。
(实验探究)请你设计实验,验证猜想:
实验操作 | 实验现象 | 实验结论 |
取足量的黄色固体加入试管,然后滴入适量的_____,并将_____放在试管口 | _____ | 猜想正确 |
(反思与交流)
①通过上述探究活动,你对燃烧有什么新认识:_____。
②空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,这是因为_____。