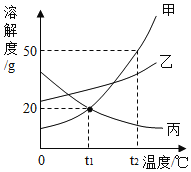
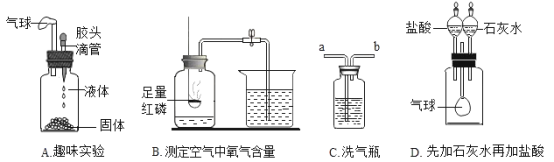
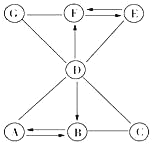
��Ŀ����
����Ŀ�������DZ仯�ģ�ͨ���о����ʵı仯���ɣ�ʵ�ֻ�ѧΪ�����������Ŀ�ģ��ǻ�ѧ��ѧ�ĺ���������������5���仯��
��100gҺ̬ˮ������ȫ������õ�100gˮ��������п��ϡ���ᷴӦ��ȡ����������ʯ���кͷ�ˮ�е�����ܳ���������Ȼ�������ݷ���Һ̬������ȡ��������ش��������⣺
��1��д��������ѧ�仯�Ļ�ѧ��Ӧ����ʽ��_____
��2������֮���Է�����ѧ��Ӧ�����۵ĽǶȿ�������Ϊ��Ӧ�����֮����һ�������·�����Ч������ã�ʹ���Ľṹ�����ı䣬��������������ϣ�����ϱ���Ϊ�������µ����ʡ���Ӧ��������õ������ǣ��÷��ű�ʾ��_____��
��3����Ӧ�õĽǶȿ��������仯�����û�ѧ�仯��ȡ�������ʵ��ǣ�����ţ�_____�������к����ʵ���_____�����ǽ�_____��ת��Ϊ_____�ܡ�
���𰸡�Zn+H2SO4�TZnSO4+H2����Ca��OH��2+2HCl�TCaCl2+2H2O��CH4+2O2![]() CO2+2H2O H+��OH�� �� �� ��ѧ ��
CO2+2H2O H+��OH�� �� �� ��ѧ ��
��������
��1��п�����ᷴӦ��������п���������������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ������������ڵ�ȼ�����������ɶ�����̼��ˮ����ѧ����ʽΪ��Zn+H2SO4�TZnSO4+H2����Ca��OH��2+2HCl�TCaCl2+2H2O��CH4+2O2![]() CO2+2H2O��
CO2+2H2O��
��2���кͷ�Ӧ��ʵ���������Ӻ����������ӷ�Ӧ����ˮ�����Է�Ӧ��������õ�������H+��OH����
��3����Ӧ�õĽǶȿ��������仯�����û�ѧ�仯��ȡ�������ʵ��Ǣڣ������к����ʵ��Ǣۣ����ǽ���ѧ��ת��Ϊ���ܡ�

 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�����Ŀ��������ijУʵ���ҿ����գ�����ͬѧ��п��ϡ���ᷴӦ��ȡ�������������巢��װ���м���һ������п����Ȼ��60��ϡ��������μ��룬ÿ������������������±���
���� | ��һ�� | �ڶ��� | ������ |
����ϡ��������/g | 20 | 20 | 20 |
��������������/g | 0.08 | 0.08 | 0.04 |
�Լ��㣺
��1�����Ƶ�����_____g������_____gп����
��2��ʵ������ϡ���������ʵ�����������_____��д��������̣�
����Ŀ���������Ϲ㷺Ӧ�������������С�
С������ͼʾװ�ý��мס��ҶԱ�ʵ�飬̽���¶ȶ�CO��Fe2O3��Ӧ��Ӱ�죨�̶�װ���ԣ�
�������ϣ�Fe3O4�ڳ���������ϡ���ᷴӦ������ʽΪ��Fe3O4+8HCl��2FeCl3+FeCl2+4H2O������CuSO4��Һ��Ӧ��
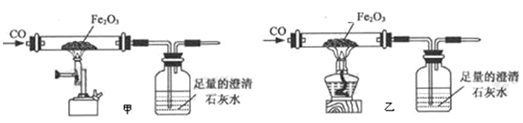
A ʵ�鿪ʼʱӦ��ͨCO��Ŀ���ǣ�_____��
B �ӻ����Ƕȿ��ǣ�ͼʾװ�û�Ӧ��ȡ�ĸĽ���ʩ��_____��
C ��ʵ������У�����ʯ��ˮ������ǣ������Ļ�ѧ��Ӧ����ʽΪ��_____����ȫ��Ӧ��������������Ϊ��ɫ��ĩ����������ֱ��������������������ʵ�飺
���� | ���� | �������� | �������� |
1 | ȡ��ɫ��ĩ���ô������� | �ܱ����� | �ܱ����� |
2 | ȡ��ɫ��ĩ������ϡ���� | ȫ���ܽ⣬�д������� | ȫ���ܽ⣬�����ݲ��� |
3 | ȡ��ɫ��ĩ����������CuSO4��Һ | �к�ɫ���ʲ��� | ���������� |
��1������ĺ�ɫ��ĩ��ϡ���ᷴӦ�Ļ�ѧ����ʽ��_____��
��2������ʵ����������ʵ�鲣�����з����ķ�Ӧ����ʽΪ��_____��
��3���ס�������ʵ��˵���¶ȶ�CO��Fe2O3��Ӧ_____�����С���ȷ����Ӱ�졣