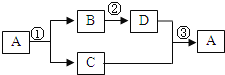
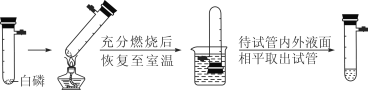
题目内容
【题目】(5分)下图是氧元素、铝元素在周期表中的部分信息,以及四种粒子的结构示意图。

根据图示回答下列问题:
(1)氧原子的原子核内质子数是 ,铝的相对原子质量是 ;
(2)写出甲和乙形成化合物的化学式 ;
(3)粒子B的符号为 ;
(4)D粒子中X= 。
【答案】(1)8 26.98 (2)Al2O3 (3)Al3+ (4)12
【解析】
试题分析:
在图甲中 数字8是原子序数,原子序数在数字上等于该原子的质子数,故氧原子的质子数为8;在图乙中,26.98表示的是铝原子的相对原子质量,故铝原子的相对原子质量为26.98;
铝元素在化合物里显+3价,氧元素显+2价,根据十字交叉法可知,正左负右,十字交叉,约最简,其化学式为Al2O3
(3)比较图A和图B,图B是图A失去三个电子之后形成的离子,失去电子带正电,书写离子符号时,电荷标在元素符号的右上角,且数字在前符号在后故粒子B的符号为Al3+
(4)原子中质子数等于电子数故X=2+8+2=12

 步步高达标卷系列答案
步步高达标卷系列答案【题目】向饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而是溶液变浑浊,发生反应的化学方程式为Na2CO3 + CO2 + H2O = 2NaHCO3。某化学小组同学用下图装置探究影响碳酸氢钠晶体产生快慢的因素,结果如下表。下列判断不正确的是
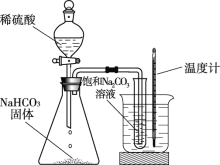
序号 | 温度/℃ | CO流速 (个气泡/秒) | 出现浑浊 的时间 |
① | 25 | 5~8 | 5′17″ |
② | 40 | 5~8 | 3′48″ |
③ | 25 | 10~13 | 5′02″ |
④ | 25 | 2~5 | 5′40″ |
A. 锥形瓶中反应的化学方程式为2NaHCO3 + H2SO4 = Na2SO4 + H2O + CO2↑
B. ①②对比可知,其他条件相同时,温度越高,析出晶体越快
C. ③④对比可知,其他条件相同时,CO2流速越大,析出晶体越快
D. ①③对比可知,二氧化碳的流速是影响析出晶体快慢的主要因素
【题目】小王同学在化工颜料店发现一种“银粉”,他猜想该“银粉”可能是银粉、铝粉或锌粉中的一种。为了确定“银粉”的成分,小王将一小包“银粉”带回实验室,并进行了如下实验和相关分析。
(1)取少量“银粉”于试管中,滴加适量盐酸,观察到_____,说明“银粉”一定不是银。
(2)为了进一步确定“银粉”是铝还是锌,小王通过理论计算,获得了铝与足量盐酸反应产生氢气的质量关系,并绘制了铝的图象(如图)。
Zn的质量/g | 0 | 3.25 | m | 9.75 | 13 | 16.25 |
H2的质量/g | 0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
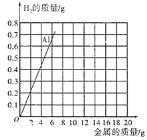
①如表是锌与足量盐酸反应产生氢气的质量关系,请计算表中m的值(利用化学方程式进行计算,写出完整的计算过程)。_____。
②请你在该图中绘制出锌的图象。_____
(3)取1.8g“银粉”(杂质忽略不计)加入到50g稀盐酸中,恰好完全反应,生成氢气0.2g。根据如图可知,“银粉”是_____。
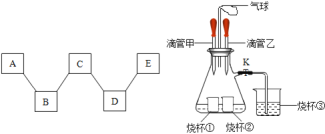
【题目】以下均为初中化学常见物质,由H、C、N、O、S、Na、Ca、Fe等元素中的一种或几种组成,化学小组做了如图实验,请回答:
(1)甲组同学实验中观察到溶液由无色变为浅绿色,则发生反应的方程式为_____;
(2)乙组同学通过实验发现五种物质之间的关系如图所示,“﹣﹣”两端的物质在一定条件下可以反应.若A~E分别属于单质、氧化物、酸、碱、盐中的四种类别,且有黑色固体、白色固体、黄色溶液、大量气泡等现象产生,则C的化学式为_____,D与E反应的化学方程式为_____,A与B反应的化学方程式为_____.
(3)丙组同学按图2进行实验,先关闭弹簧夹K,将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,打开弹簧夹K,烧杯③中液体倒流入锥形瓶中,且锥形瓶底部溶液由红色变为无色,无其它明显现象.请将下表中的试剂补充完整.
滴管甲 | 烧杯① | 滴管乙 | 烧杯② | 锥形瓶中溶液 | 烧杯③ | |
试剂 | H2O | _____ | _____ | _____ | _____ | _____ |