题目内容
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们一起完成以下实验探究。
(1)(演示实验)将一定量稀盐酸加入到盛有氢氧化钙溶液的小烧杯中,该反应的化学方程式是____。
(查阅资料)CaCl2溶液显中性
(提出问题)实验中同学探究反应后溶液中溶质的成分是什么?
(2)(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有_____;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是______。
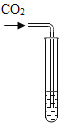
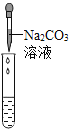
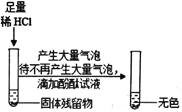
(3)(实验探究)为了验证其余猜想,各小组分别进行下列三个方案的探究
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ________ | ________ | 产生白色沉淀 |
实验结论 | 猜想Ⅱ正确 | 猜想Ⅲ正确 | 猜想Ⅰ或猜想Ⅲ正确 |
【答案】Ca(OH)2+2HCl=CaCl2+2H2O CaCl2、HCl 盐酸和氢氧化钙不能共存 溶液变红色 产生白色沉淀
【解析】
(1)氢氧化钙和稀盐酸反应生成氯化钙和水,该反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O。
(2)猜想Ⅰ:恰好完全反应时溶质只有CaCl2;
猜想Ⅱ:盐酸过量时溶质有CaCl2、HCl;
猜想Ⅲ:氢氧化钙过量时溶质有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
猜想Ⅳ不合理,盐酸和氢氧化钙不能共存。
(3)
实验探究:
滴加紫色石蕊溶液,溶液变红色,说明溶液显酸性,说明溶液中含有盐酸,猜想Ⅱ正确;
通入二氧化碳时产生白色沉淀,说明溶液中含有氢氧化钙,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,猜想Ⅲ正确;
滴加碳酸钠溶液时,产生白色沉淀,说明溶液中含有氯化钙或氯化钙和氢氧化钙,钙离子和碳酸根离子反应生成碳酸钙沉淀,猜想Ⅰ或猜想Ⅲ正确。
实验过程如下所示:
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | 溶液变红色 | 产生白色沉淀 | 产生白色沉淀 |
实验结论 | 猜想Ⅱ正确 | 猜想Ⅲ正确 | 猜想Ⅰ或猜想Ⅲ正确 |

 教材全解字词句篇系列答案
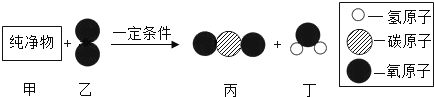
教材全解字词句篇系列答案【题目】工业上用高温煅烧石灰石制备CO2,某探究小组欲探究煅烧后的固体残留物成分
[资料] ①CaO +2HCl = CaCl2+ H2O ②CaCl2溶液呈中性
(1)高温煅烧石灰石的方程式为___________________,根据化学方程式进行猜想:
猜想一:只有CaO,猜想二:有 CaO和________________
[实验验证]
(2)两位同学设计实验方案如下表
甲同学 方案一 | 乙同学 方案二 | |
实验步骤现象 |
|
|
①据甲同学方案一中现象,可判断剩余固体中一定含有_______,用方程式解释__________。
②乙同学认为猜想二一定正确,该同学的方案是否合理?_______,理由是______________。
③丙同学认为结合方案一和方案二可以判定猜想二成立,该观点____(填“正确”或“不正确”)
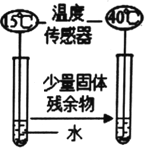
[讨论与反思]小组同学认为,导致残余固体中不止含有一种物质的原因可能是石灰石的状态导致的,为此他们模拟工业操作,在实验室高温煅烧石灰石,相关记录如下表
石灰石(不含杂质) | 状态 | 温度 | 最终收集到CO2的质量 | |
实验1 | 2g | 块状 | 800℃ | 0.748g |
实验2 | 未知 | 粉末状 | 800℃ | 0.876g |
(3)上表中实验1中的产率为___________(产率=实际产物质量÷理论产物质量×100%),为了达成实验目的,实验2中未知质量应该是__________g,
[反思总结]
(4)从表中数据可知,高温煅烧石灰石最好选择_______状态反应更充分,理由是________。
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
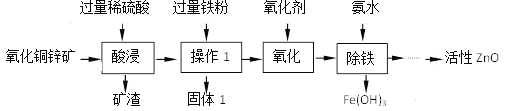
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。
【题目】下表是几种家用清洁剂的功能和有效成分。
清洁剂 |
洁厕灵 |
彩漂液 |
漂白水 |
功能 | 清除污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 漂出衣物污渍 |
有效成分 | HCl | H2O2 | NaClO |
根据表中信息,回答下列问题。
(1)大理石上的污垢不能用“洁厕灵”清洁的理由是____________。
(2)在盛有少量“彩漂液”的试管中,加少量二氧化锰,观察到的现象是____________。
(3)“洁厕灵”与“漂白水”不能混用。二者若混合其有效成分之间能发生化学反应,产生氯化钠、水和有毒的氯气(C12),化学方程式为____________。