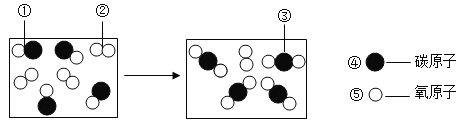
题目内容
【题目】合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图 如下:
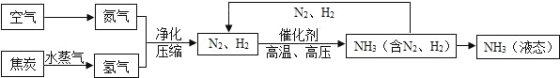
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为_____.
(2)制取氢气的反应过程为:C+H2O![]() CO+H2,CO+H2O
CO+H2,CO+H2O![]() CO2+H2.上述两个化学方程式中表现 氧化性的物质是_____(填化学式).
CO2+H2.上述两个化学方程式中表现 氧化性的物质是_____(填化学式).
(3)原料中 N2、H2 中常含有 CO2 和水蒸气,反应前要净化.净化的过程是_____.
(4)写出 N2、H2 反应生成 NH3 的化学方程式_____.
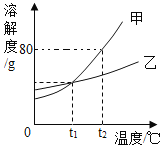
(5)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在﹣183℃时,可将空气中 N2 与 O2分离.根据表中物质的沸点判断,要将产物 NH3 与 N2 、H2 分离开来,最适宜的温度应该控制在___℃
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
【答案】78%(或 4/5) H2O 先把原料气通过 NaOH 溶液(或石灰水等碱液),再通过浓硫酸(或碱石灰等干燥剂) N2+3H2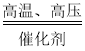 2NH3 ﹣33.35
2NH3 ﹣33.35
【解析】
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为78%或4/5;
(2)水在上述两个化学方程式中,提供氧元素,表现为氧化性;
(3)杂质CO2和水蒸气,分别用碱溶液和浓硫酸除去,要先除杂质再干燥;故净化的过程是:先把原料气通过NaOH 溶液(或石灰水等碱液),再通过浓硫酸(或碱石灰等干燥剂)
(4)氮气和氢气在有催化剂和高温高压的条件下生成氨气,化学反应方程式为N2+3H2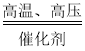 2NH3
2NH3
(5)根据表中物质的沸点判断,要将产物 NH3 与 N2、H2 分离开来,最适宜的温度应该控制在﹣33.35℃。

【题目】黄铜是铜和锌所组成的合金,用途广泛。某兴趣小组为探究某黄铜合金的组成,取20g粉末状矿黄铜合金样品,把60g稀硫酸平均分成三等份,分三次(每次20g)加入样品中,均有气体产生,充分反应后,过滤出固体,将其用蒸馏水洗涤、干燥、称量,得实验数据如表:
第一次 | 第二次 | 第三次 | |
剩余固体的质量/g | 16.75 | 13.5 | 12.4 |
计算:
(1)该黄铜合金中,锌的质量分数为_____。
(2)20g实验所用稀硫酸中硫酸的质量为_____。
(3)第二次实验后,将第一、二次实验所得滤液合并(含洗涤用蒸馏水53.7g),求所得溶液中溶质的质量分数(不考虑过程中的损失)。____(写出计算过程,结果保留到0.1%)。
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
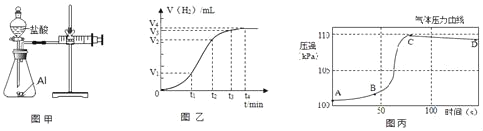
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。