题目内容
【题目】黄铜是铜和锌所组成的合金,用途广泛。某兴趣小组为探究某黄铜合金的组成,取20g粉末状矿黄铜合金样品,把60g稀硫酸平均分成三等份,分三次(每次20g)加入样品中,均有气体产生,充分反应后,过滤出固体,将其用蒸馏水洗涤、干燥、称量,得实验数据如表:
第一次 | 第二次 | 第三次 | |
剩余固体的质量/g | 16.75 | 13.5 | 12.4 |
计算:
(1)该黄铜合金中,锌的质量分数为_____。
(2)20g实验所用稀硫酸中硫酸的质量为_____。
(3)第二次实验后,将第一、二次实验所得滤液合并(含洗涤用蒸馏水53.7g),求所得溶液中溶质的质量分数(不考虑过程中的损失)。____(写出计算过程,结果保留到0.1%)。
【答案】38% 4.9g 16.1%
【解析】
(1)因为铜和锌所组成黄金中,铜不与稀硫酸反应,所以由表格可知铜的质量为12.4g,则锌的质量=20.00﹣12.4=7.60g,锌的质量分数=![]() ;
;
(2)由数据可知20g硫酸恰好和20g﹣16.75g=3.25g锌反应,
设20g实验所用稀硫酸中硫酸的质量为x,生成硫酸锌的质量是y 生成氢气的质量是z
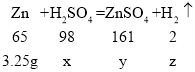
![]() x=4.9g
x=4.9g
![]() y=8.05g
y=8.05g
![]() z=0.1g
z=0.1g
(3)由表格可知第一次剩余固体16.75g,第二次为13.50g,说明前两次参加反应的锌的质量是=3.25g×2=6.5g;参加反应的硫酸溶液的质量是40g,生成硫酸锌的质量是8.05g×2=16.1g;生成氢气的质量是0.1g×2=0.2g;则将第一、二次实验所得滤液合并(含洗涤用蒸馏水53.7g),所得溶液中溶质的质量分数为:![]() 。
。

练习册系列答案
相关题目