题目内容
【题目】请你参与以下2个实验探究活动并回答其中的问题。
Ⅰ SO2和Cl2均能将湿润的有色物质漂白成无色物质。某兴起小组为验证SO2和Cl2的漂白性,设计了如下方案(尾气处理装置未画出)。
(1)如下图所示,通入干燥的Cl2后,同学们发现甲中红色布条不褪色,乙中红色布条褪色了,此实验中控制的变量是_________,该实验中发生了“Cl2+H2O=HCl+HClO”反应,若要说明HClO具有漂白性,需要补充的实验是__________。将乙中的布条取出烘干,发现未变为原来的红色,说明HClO漂白性是_______(填“可恢复的”或“不可恢复的”)。
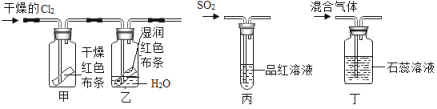
(2)如图丙所示,向品红溶液中通停止通气体,加热试管,发现试液又变为红色,说明SO2漂白的反应原理与Cl2漂白的反应原理是_____________(填“相同的”或“不同的”)
(3)如图丁所示,将干燥的Cl2和SO2按分子数之比1:1混合,通入石蕊试液中,发现石蕊试液变红,却不褪色。试用化学反应方程式作出解释(已知:生成物中氯元素显-1价,硫元素显+6价):__________。
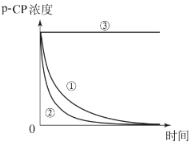
Ⅱ Fenton法常用于处理含难降解有机物的工业废水,其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分,现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或者40℃(其余实验条件见下表),设计如下对比试验。
(1) 请完成以下实验设计表(表中不要留空格)
实验编号 | 实验目的 | 温度 ℃ | pH | 浓度/(mgL-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ___ | ___ | 204 | 16.8 |
③ | _____________________________ | 25 | 10 | 204 | 16.8 |
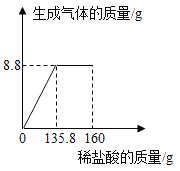
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
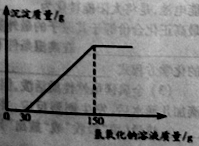
镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)