题目内容
【题目】一定质量的某有机物完全烧生成2.2gCO2和0.9gH2O;另取9.2g该有机物在O2中完全燃烧,消耗3.2gO2。则下列有关说法正确的是
A. 有机物的化学式为:C2H2O2B. 有机物中碳的质量分数为41.4%
C. 有机物中H、C、O的质量比为1:6:16D. 完全燃烧的方程式中有机物与氧气的化学计量数之比为1:2
【答案】C
【解析】
根据质量守恒定律,有机物燃烧生成二氧化碳和水可知有机物中一定含有C、H两种元素,利用化学反应前后元素的种类与质量不变计算出化合物中各元素的含量,最后计算出各元素的原子个数比。
因为“一定质量的某有机化合物完全燃烧,生成2.2gCO2和0.9gH2O,另取9.2g该有机化合物在O2中完全燃烧,消耗3.2gO2”,由质量守恒定律可知,9.2g该有机化合物在O2中完全燃烧,消耗3.2gO2,同时生成8.8gCO2和3.6gH2O,该有机物中含碳元素的质量为:![]() ,含氢元素的质量为:
,含氢元素的质量为:![]() ,则其中含氧元素的质量为:9.2g-2.4g-0.4g=6.4g,则该有机物中,碳、氢、氧的原子个数比为:
,则其中含氧元素的质量为:9.2g-2.4g-0.4g=6.4g,则该有机物中,碳、氢、氧的原子个数比为:![]() ,故该有机物的化学式为CH2O2,
,故该有机物的化学式为CH2O2,
A、若有机物的化学式为C2H2O2,碳、氢、氧的原子个数比为1:1:1,与计算出的结果不符合,故错误;
B、有机物中碳的质量分数为![]() ,故错误;
,故错误;
C、有机物中H、C、O的质量比为=![]() =1:6:16,故正确;
=1:6:16,故正确;
D、完全燃烧的方程式中有机物与氧气的化学计量数之比为![]() =2:1,故错误;
=2:1,故错误;
故选:C。

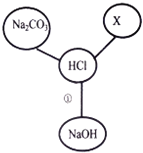
【题目】请你参与以下2个实验探究活动并回答其中的问题。
Ⅰ SO2和Cl2均能将湿润的有色物质漂白成无色物质。某兴起小组为验证SO2和Cl2的漂白性,设计了如下方案(尾气处理装置未画出)。
(1)如下图所示,通入干燥的Cl2后,同学们发现甲中红色布条不褪色,乙中红色布条褪色了,此实验中控制的变量是_________,该实验中发生了“Cl2+H2O=HCl+HClO”反应,若要说明HClO具有漂白性,需要补充的实验是__________。将乙中的布条取出烘干,发现未变为原来的红色,说明HClO漂白性是_______(填“可恢复的”或“不可恢复的”)。
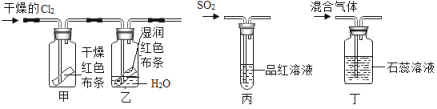
(2)如图丙所示,向品红溶液中通停止通气体,加热试管,发现试液又变为红色,说明SO2漂白的反应原理与Cl2漂白的反应原理是_____________(填“相同的”或“不同的”)
(3)如图丁所示,将干燥的Cl2和SO2按分子数之比1:1混合,通入石蕊试液中,发现石蕊试液变红,却不褪色。试用化学反应方程式作出解释(已知:生成物中氯元素显-1价,硫元素显+6价):__________。
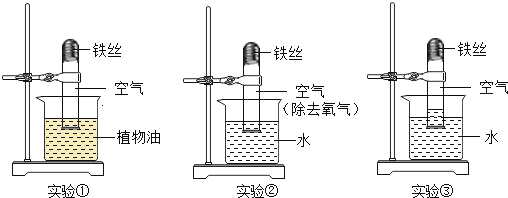
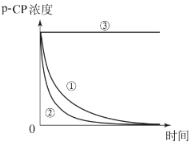
Ⅱ Fenton法常用于处理含难降解有机物的工业废水,其原理是利用Fe2+和H2O2的反应产生能降解污染物的活性成分,现运用该方法降解有机污染物p-CP,探究有关因素对降解反应速率的影响。
实验探究:控制p-CP的初始浓度相同,实验温度恒定在25℃或者40℃(其余实验条件见下表),设计如下对比试验。
(1) 请完成以下实验设计表(表中不要留空格)
实验编号 | 实验目的 | 温度 ℃ | pH | 浓度/(mgL-1) | |
H2O2 | Fe2+ | ||||
① | 为②③提供参照 | 25 | 3 | 204 | 16.8 |
② | 探究温度对降解反应速率的影响 | ___ | ___ | 204 | 16.8 |
③ | _____________________________ | 25 | 10 | 204 | 16.8 |
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
【题目】除去下列物质中混有的杂质,所用试剂和操作方法不正确的是![]()
物质 | 所含杂质 | 除杂质选用的试剂或方法 | |
A | NaCl溶液 | NaOH | 滴加适量的稀盐酸 |
B | Cu | Fe | 加入足量的稀盐酸并过滤 |
C |
| CO | 在氧气中点燃 |
D |
|
| 加入足量的水溶解并过滤、洗涤、干燥 |
A. A B. B C. C D. D