题目内容
【题目】下列应用对比实验设计的方案中,设计不正确的是( )
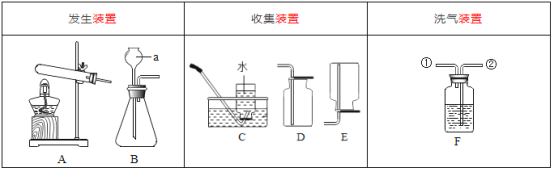
A.  探究气体分子间的间隔与液体分子间间隔的大小
探究气体分子间的间隔与液体分子间间隔的大小
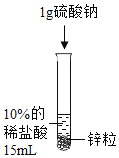
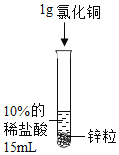
B. 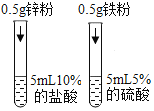 探究Zn、Fe金属的活动性强弱
探究Zn、Fe金属的活动性强弱
C.  探究CO2与氢氧化钠的反应
探究CO2与氢氧化钠的反应
D. 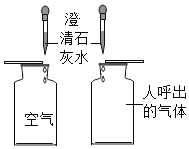 探究空气与呼出气体CO2的含量
探究空气与呼出气体CO2的含量
【答案】B
【解析】
A、等体积空气和水,装空气的注射器更容易被压缩,说明气体分子的间隔比液体分子的间隔大,故本选项不符合题意;
B、两支试管中的酸的种类不同,不能用来探究金属活动性强弱,故对比试验设计不合理,故本选项符合题意;
C、氢氧化钠溶液中有氢氧化钠和水,两个塑料瓶中都含有水,对比塑料变瘪的程度能说明二氧化碳是否能和氢氧化钠反应,故对比试验设计合理,故本选项不符合题意;
D、实验过程中,呼出气体使澄清石灰水变浑浊比空气明显,说明呼出气体中二氧化碳的含量高,故对比试验设计合理,故本选项不符合题意。
故选:B。

【题目】我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:
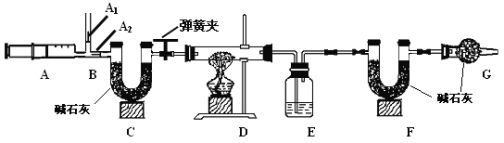
已知:1.碳酸钠比较稳定,加热不分解;
2. 2NaHCO3![]() Na2CO3 +CO2 ↑+H2O
Na2CO3 +CO2 ↑+H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,
A1打开进空气,A2关闭。
(一)实验步骤
(1)实验时,组装好装置,实验前应先 ,后续实验步骤是:
① 反复推拉注射器
② 称量E、F的质量
③ 关闭弹簧夹,加热D处试管直到反应不再进行
④ 打开弹簧夹,再次反复缓缓推拉注射器
⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。实验过程中,C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
反应前 | 反应后 |
E的质量为100.0g | E的质量为102.25g |
F的质量为50.0g | F的质量为51.1g |
则: ① 碳酸氢钠分解生成二氧化碳的质量为 g
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。
【题目】某化学兴趣小组对氢气的实验室制法,进行了一系列实验探究。
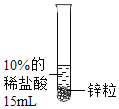
(1)小组用锌与稀盐酸反应制取氢气,该反应的化学方程式为_____。
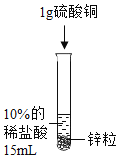
(2)为了加快锌与稀盐酸的反应速率,老师提示可向反应物中加入少量硫酸铜固体,为了弄明白速率加快的原因,小组同学提出了以下猜想。
(猜想与假设)甲同学:可能与硫酸根离子有关;
乙同学:可能与铜离子有关;
丙同学:可能与铜单质有关。丙同学猜想的依据是_____。
设计并进行实验室温时,小组同学按下表进行实验,观察并记录现象。
实验序号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
产生气泡的快慢 | 较快 | 明显加快 | 较快 | 明显加快 |
(分析并得出结论)
(3)由实验①和实验③发现反应速率几乎没有变化得出甲同学的猜想_____(选填“正确”或“不正确”)。
(4)实验④是将硫酸铜换成氯化铜进一步验证猜想,丙同学认为不需要替换试剂,只需通过观察实验②的现象就可以验证,该反应的现象为_____。此反应发生后反应速率加快依然较明显,小组同学得出_____的猜想正确。
(5)请你重新设计一个实验方案验证丙同学的猜想。实验方案:_____。