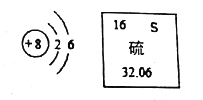
题目内容
【题目】铜锈,俗称“铜绿”,主要成分是Cu2(OH)2CO3。课外活动小组围绕铜生锈的条件展开探究:

(查阅资料)二氧化碳易与氢氧化钠溶液发生化学反应,生成碳酸钠和水。
提出问题)铜在什么条件下会生锈?
(假设猜想)根据铜锈主要成分的化学式,猜想铜生锈可能是铜与空气中水、氧气、_______共同作用的结果。
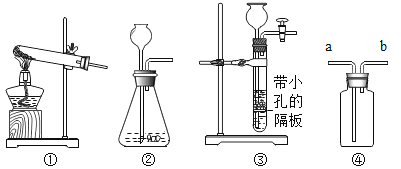
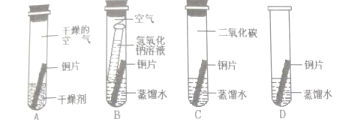
(探究过程)小组同学设计了“铜片锈蚀条件的探究”实验如上图所示:实验进行较长一段时间后,观察现象可发现_______(填序号)试管中的光亮铜片最先生锈。B试管中氢氧化钠溶液的作用____________。
(评价与改进)我认为课外小组设计的实验不够完普,若要得出正确结论,还要补充的一个实验是(也可在上面方框内画图表示)_____________
(反思与小结)补充实验后,通过实验证明了原猜想正确,则铜生锈变成铜绿的化学方程式为______
(拓展应用)写出一种防止铁或铜等金属制品生锈的具体方法为______。
【答案】CO2 D 除去空气中的CO2(或吸收CO2)  2Cu+O2+H2O+CO2═Cu2(OH)2CO3 刷油漆(或涂油、或保持干燥清洁等)
2Cu+O2+H2O+CO2═Cu2(OH)2CO3 刷油漆(或涂油、或保持干燥清洁等)
【解析】
[假设猜想]碱式碳酸铜中含有碳,氢,氧,铜四种元素,根据质量守恒定律,反应物中也应该含有这四种元素,除了氧气外,空气中含有碳和氢的物质就是水和二氧化碳;
[探究过程]D中铜与空气中的水、氧气和二氧化碳三种物质充分接触,容易生锈;氢氧化钠能和二氧化碳反应生成碳酸钠和水,B试管中氢氧化钠溶液的作用是 除去空气中的CO2;
[评价与改进]对比四组实验,结合铜生锈的条件,还需要在隔绝氧气、二氧化碳,只需要浸没在水中,并加入适量植物油,如图: ;
;
[反思与小结]由实验现象可知,铜在氧气、水、二氧化碳同时存在的情况下最容易生锈,化学方程式为:2Cu+O2+H2O+CO2═Cu2(OH)2CO3;
[拓展应用]在铁或铜等金属制品表面刷漆可以防止金属生锈。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
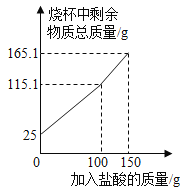
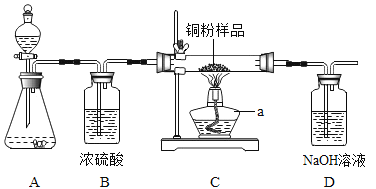
暑假作业安徽少年儿童出版社系列答案【题目】如下图所示,某校化学兴趣小组用过氧化氢(H2O2)溶液(MnO2作催化剂) 制取干燥氧气,并用来测定 10g 某铜粉样品(含少量杂质碳)中铜的质量分数。
回答下列问题:(温馨提示:2Cu+O2![]() 2CuO;氢氧化钠溶液可以吸收二氧化碳)
2CuO;氢氧化钠溶液可以吸收二氧化碳)
(实验一)
(1)装置A 中发生的化学方程式是__________。装置B的作用是__________。
(2)通过称量完全反应前后装置__________的质量,进行计算便可求出样品中铜的质量分数。
(3)实验完毕,小华同学误将用剩的H2O2溶液和装置C玻璃管中的剩余固体一起倒入烧杯中,发同有大量的气泡产生,经检验确认产生的气体是氧气,小江和小田两位同学对此颇感兴趣,进而展开了他们的探究之旅。
(提出问题)
是哪种物质加快了H2O2的分解速率?
(大胆猜想)
猜想①:剩余固体中的氧化铜加快了H2O2溶液的分解。
猜想②:氧化铜能做H2O2分解的催化剂。
(实验二)
实验方案 | 实验现象 | 分析及结论 |
步骤一:将带火星的木条伸入盛有5mL5%过氧化氢溶液的试管。 | 带火星木条不复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星复燃。 |
步骤二:向盛有 5mL5%H2O2溶液的试管中加入 1g 氧化铜固体,将一根带火星的木条伸入试管中。观察现象。待反应结束后将试管里的剩余物进行___________、洗涤、干燥、称量。对比反应前后固体的质量。 | 称得固体质量为 1g | 猜想①成立,并且反应前后固体的质量相等。 |
(讨论交流)
小川同学认为,根据步骤一、二的实验现象,得出的两个结论就能判断猜想②成立。你是否支持他的观点?___________。若要证明猜想②成立,你认为还应补做的实验是___________。
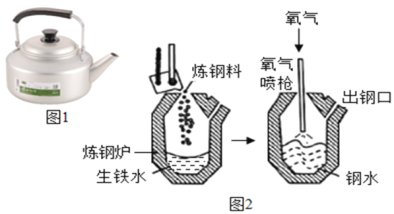
(4)该化学兴趣小组利用压强传感器,对MnO2、CuO、Fe2O3三种金属氧化物中,哪一个更适宜作过氧化氢制取氧气的催化剂,又做了如下数字化实验探究。
(实验三)实验方法如下:
Ⅰ.用MnO2、CuO、Fe2O3三种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
Ⅱ.取30粒含MnO2的海藻酸钠微球,采用如下图所示装置进行实验。改用其他两种微球,分别重复上述实验,得到的锥形瓶内压强随时间变化的曲线如下图所示。
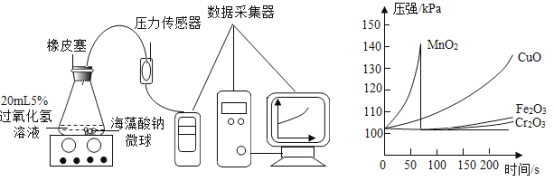
①每次重复实验时,海藻酸钠微球数应相同的原因是_________________________________。
②用含MnO2的海藻酸钠微球进行实验,60s 时压强瞬间回落,其原因可能是____________________。
③从实验曲线看,催化效果较好,反应温和的催化剂是______________________。
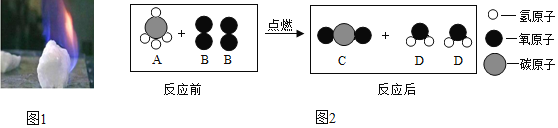
【题目】在一密闭容器内有氧气、氮气、水蒸气和一种初中课本中出现的气体物质W,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法中错误的是( )
物质 | W | 氧气 | 氮气 | 水蒸气 |
前质量/g | 68 | 100 | 2 | 2 |
反应后质量/g | X | 4 | 58 | 110 |
A. X的值应为0
B. 反应前后氮元素的化合价发生了变化
C. 物质W中不含氧元素
D. W与氧气的相对分子质量之比为17:24