��Ŀ����
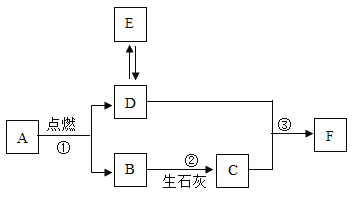
����Ŀ����ҵ���Ʊ��ĸ���������̵���Ҫ����������ǹ�ҵ�������̿���Ҫ�ɷ���MnO2���Ʊ�������ص�һ�ֹ������̣�

��1������I��������______��
��2������IIѡ�ñ����������Һϴ�ӵ�ԭ����______��
��3��д����Ӧ�۵Ļ�ѧ����ʽ______���÷�Ӧ���ڵĻ�����Ӧ����Ϊ______��
��4�����������п���ѭ��ʹ�õ�������________��д��ѧʽ����
��5���ڸ����������У���90kg���̿��Ƶ���158kg�ĸ�����أ���������ǹ����е���ģ��ɼ�������̿���MnO2����������Ϊ______�����������һλС����
���𰸡����� ���ٸ�����ص��ܽ� K2CO3+Ca(OH)2�TCaCO3��+2KOH ���ֽⷴӦ KOH��MnO2 96.7%
��������
��1������I���Խ�������Һ��Ĺ����Һ����룬���������ǹ��ˣ�
��2������II��ϴ�Ӹ�����ش־��壬ѡ�ñ����������Һϴ�ӵ�ԭ���Ǽ��ٸ�����ص��ܽ���ʧ��
��3���������ƺ�̼��ط�Ӧ����̼��Ƴ������������أ���ѧ����ʽΪ��K2CO3+Ca(OH��2=CaCO3��+2KOH���÷�Ӧ�����ֻ����サ���ɷ��������ֻ��ϵķ�Ӧ�����ڸ��ֽⷴӦ��
��4��ѭ��ʹ�õ����ʼ��Ƿ�Ӧ�����������ж����е����ʣ���Ӧ�����������о���������������������̣���ѭ��ʹ�õ����ʣ���ѧʽΪ��KOH��MnO2��
��5����������̵���������Ϊx
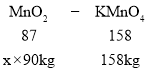
![]()
x��96.7%�������̿���MnO2����������Ϊ96.7%��

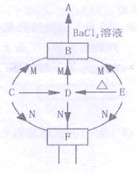
 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ��������۩��۩�������֮�佨����ϵ����ѧϰ��ѧ��һ����Ҫ��˼ά��ʽ����ͼ��Ԫ�����ڱ��в���Ԫ�ص�ԭ�ӽṹʾ��ͼ��������ѧ֪ʶ�ش����е����⣮
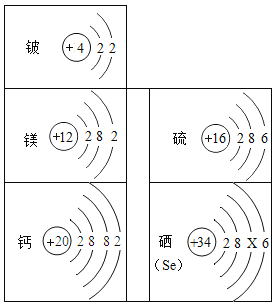
��1����ԭ�ӽṹʾ��ͼ�е�X=____����Ԫ������______�����������������ǽ�������Ԫ�أ�
��2��Ӳˮ�к��еĽ�������Ϊ________�������ӷ��ţ���
��3����Ԫ�غ���Ԫ�صĻ�ѧ�������ƣ���������Ļ�ѧʽΪ________��
��4����Է����������״���µ��������֮����ڽ��ܵĹ�ϵ�����±����������±��жϣ���״����22.4L����������YΪ______��������±����ɳ�һ�����ɣ�______��
���� | ���� | ���� | |
��Է������� | 2 | 32 | 28 |
��״���£�22.4L��������� | 2g | 32g | Y |
����Ŀ����ѧʵ��̽������������ͬѧ�ǵ���Ȥ��ij��ѧ��ȤС����ʵ����ʵ��ʱ������һƿ��ǩȱ�����Һ����ͼ1��Ϊ��ȷ�������ʳɷ֣�ͬѧ�ǽ���������̽����
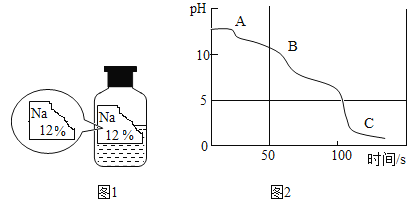
��������룩
����һ��NaCl�� �������Na2CO3����������NaHCO3 �����ģ�NaOH
�����ʵ��һ��
С��ȡ������Һ��Ʒ���Թ��У��ò�����պȡ��Һ����pH��ֽ�ϣ���ȡ���ݣ�pH=9���ó����ۣ������ij�����
С����ΪС���Ľ��۲�ȷ�������ǣ�______��
��С����ʵ�����п����жϳ�����______Ҳһ���Ǵ���ġ�
�����ʵ�����С��ȡ����ϡ�������Թ��У��ݼ���������Һ����Һ�в������ݡ�������Ϊ�������ȷ��
С����Ϊ��Ȼ����ȷ����������______��
���������ϣ������£�̼���ƺ�̼�����Ƶ��ܽ��Ϊ���±����е����ݡ�
Na2CO3 | NaHCO3 | |
�ܽ��/g | 21.8 | 9.6 |
���������ۣ���������ʾ�����ݣ��ٽ��ҩƷ�ı�ǩ�������жϲ���______����ȷ��������______��
�����⽻������1��Na2CO3��NaHCO3�������б���Ϊ���մ��ֵ���������NaHCO3�������п�����______��д��һ�����ɣ���
��2��Na2CO3�ڿ����г��ڷ��ã������տ�����ˮ��������һ�������ת���NaHCO3������д����Ӧ����ʽ______����ȤС�����ʦһ�����ʵ�飬������μӵ�Na2CO3��Һ�н��з�Ӧ���������ֻ�ʵ��װ��pH�������ⶨ����Һ��pH�ı仯���ɼ����ݵõ�������ͼ2��ʾ��0-50sʱ��ͬѧ�ǹ۲쵽��Һ�в�û�������е����ݲ�����B����ҺpH����7������Ϊ______�����������ƣ���ˮ��Һ�ʼ��ԡ�
��3��C��������Һ��������______��