题目内容
【题目】将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉(C)混合后加热到约800℃,得到一种锌和铜的合金——黄铜,外观似黄金但质地坚硬。
(1)上述物质中,属于氧化物的是_________。
(2)赤铜(Cu2O)中铜的化合价为______,800℃时,赤铜和木炭粉发生置换反应生成的单质是_________。
(3)已知![]() ,若原料中含25吨ZnCO3 ,请列式计算充分反应后,理论上所得黄铜中锌的质量_________。
,若原料中含25吨ZnCO3 ,请列式计算充分反应后,理论上所得黄铜中锌的质量_________。
【答案】Cu2O +1 铜 13吨
【解析】
(1)氧化物是两种元素组成且其中一种是氧元素的化合物,因此属于氧化物的是赤铜(Cu2O);
(2)设赤铜(Cu2O)中铜的化合价的x,则x×2+(-2)×1=0,x=+1;赤铜和木炭粉在高温下反应生成了铜和二氧化碳,反应的化学方程式是:2Cu2O+C![]() 4Cu+CO2↑,因此属于单质的是铜;
4Cu+CO2↑,因此属于单质的是铜;
(3)设反应生成的锌的质量为x,
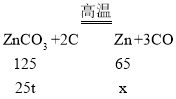
![]()
x=13t,
答:反应生成的锌的质量为13吨。

练习册系列答案
相关题目