题目内容
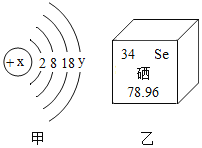
【题目】锌锰电池(俗称干电池)在生活中的用量很大,其构造如图1所示。
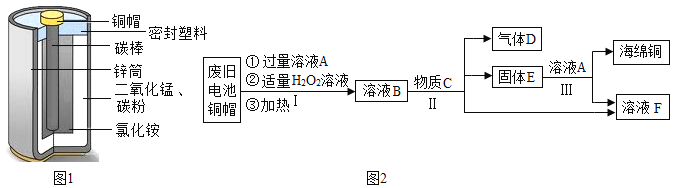
(1)根据图1判断,属于金属材料的是______。
(2)金属制品在空气中放置易生锈,铁生锈的条件是与______同时接触。废旧电池铜帽会生成一些绿色的铜锈,其主要成分为是Cu2(OH)2CO3,对比可知铜生锈除了铁生锈的条件还必须有空气中的______参与。
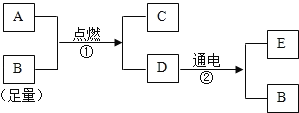
(3)利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如图2所示
①同学们查阅资料知道Cu+H2O2+H2SO4=CuSO4+2X,请推断x的化学式______。
②写出过程Ⅱ中涉及反应的化学方程式:______。(写出一个即可)
③下列说法正确的是______。
A.过程I中H2O2也有可能分解生成氧气
B.固体E是混合物
C.溶液F比溶液B中含硫酸锌的溶质质量高
(4)同学们通过查阅资料知道:锌皮为金属锌(含有少量的铁)
①取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液X和固体Y.当固体Y中只含一种物质时,溶液X中一定含有的溶质为______。(写出化学式)
②另取一块质量为6.5g锌皮与足量稀硫酸完全反应,则生成氢气的质量______0.2g(选填“<”、“>”或“=”)。
(5)另取(3)中的铜帽20克置于烧杯中,向烧杯中连续三次加入稀硫酸反应,并记录所得气体的质量,实验数据如下:
第一次 | 第二次 | 第三次 | |
连续加入稀硫酸的质量(g) | 40 | 40 | 40 |
生成气体的总质量(g) | 0.08 | 0.16 | 0.20 |
计算这种稀硫酸中溶质的质量分数为______(写出计算过程,计算结果保留一位小数)。
【答案】铜帽、锌筒; 氧气和水; 二氧化碳; H2O; Zn+H2SO4=ZnSO4+H2↑或者 Zn+CuSO4=CuSO4+Zn; ABC; ZnSO4和FeSO4; >; 9.8%
【解析】
(1)由于金属材料包括纯金属材料和合金材料,所以根据图1判断,属于金属材料的是:铜帽、锌筒;
(2)金属制品在空气中放置易生锈,铁生锈的条件是与氧气和水同时接触。废旧电池铜帽会生成一些绿色的铜锈,其主要成分为是Cu2(OH)2CO3,根据质量守恒定律以及空气中只有二氧化碳含有碳元素,对比可知铜生锈除了铁生锈的条件还必须有空气中的二氧化碳参与;
(3)①由Cu+H2O2+H2SO4=CuSO4+2X,根据质量守恒定律可得x的化学式H2O;
②过程Ⅱ有锌和硫酸铜反应以及锌与剩余的硫酸反应,所以涉及反应的化学方程式为:Zn+H2SO4=ZnSO4+H2↑或者Zn+CuSO4=CuSO4+Zn;
③A、由于过氧化氢不稳定,受热易分解,所以过程I中H2O2也有可能分解生成氧气,选项正确;
B、固体E是铜和锌的混合物,选项正确;
C、溶液F中含有后期加入的锌生成的硫酸锌以及来自溶液B中含硫酸锌,所以溶液F比溶液B中含硫酸锌的溶质质量高,选项正确。故选ABC;
(4)①取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液X和固体Y。当固体Y中只含一种物质时说明只有铜,则锌和铁反应完全,所以溶液X中一定含有的溶质为ZnSO4和FeSO4;
②假设该样品全部是锌,则生成氢气的量为x。![]()
![]()
x=0.2g
假设该样品全部是铁,则生成氢气的量为x。![]()
![]()
x=0.23g
所以6.5g锌皮与足量稀硫酸完全反应生成的氢气的质量>0.2g;
(5)根据数据可知,40g稀硫酸与锌或者铁反应生成0.08g氢气。设稀硫酸中溶质的质量分数为x。
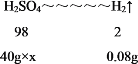
![]()
x=9.8%
答:这种稀硫酸中溶质的质量分数为 9.8%。

【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生。该小组同学进行如下探究。
(猜想与假设)小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_______。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)(1)由实验①可知,该气体中肯定含有_______。
(2)由实验②______(填“能”或“不能”)确定该气体中不含氧气,理由是______。