题目内容
【题目】在点燃条件下,A与B反应生成C和D,反应前后分子种类变化的微观示意图如下图示:
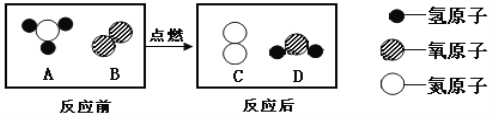
下列说法不正确的是( )
A. 该反应的本质是原子的重新组合B. 该反应中,分子个数发生了改变;
C. 该反应属于置换反应D. 该反应中,参加反应的A与B的分子数比为1:1
【答案】D
【解析】
将图对应成微粒相等如图:化学方程式为4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
A、由反应前后分子种类变化的微观示意图可知,该反应的本质是原子的重新组合,选项正确;
B、由反应前后分子种类变化的微观示意图可知,该反应中,分子个数发生了改变,选项正确;
C、在该反应中,由一种单质和化合物反应生成了另一种单质和另一种化合物,属于置换反应,选项正确;
D、由方程式可知,该反应中,参加反应的A与B的分子数比为4:3,选项错误。故选D。

【题目】清洁、高效的能源日益受到人们的重视。
(1)一氧化碳、氢气、甲烷三种气体可成为理想的燃料是____。
表1一定质量的燃料完全燃烧放出的热量
燃料 | 一氧化碳 | 氢气 | 甲烷 |
质量 | 28g | 2g | 16g |
热量(kJ) | 283.0 | 285.8 | 890.3 |
①写出一氧化碳燃烧的化学方程式________________。
②比较等质量表1中的燃料完全燃烧,放出热量最多的是_____。
(2)在红热的炭上洒少量水,炉火会烧得更旺,这是因为红热的炭能与水蒸气反应生成两种具有可燃性的气体,这两种气体是水煤气的主要成分。请写出该反应的化学方程式:____________。
【题目】某化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制备氧气,该反应的化学方程式为_______。但实验中发现制得的气体有刺激性气味,于是在老师的指导下对该气体成分进行探究。
(提出问题)刺激性气味的气体是什么呢?
(猜想与假设)
猜想一:该气体为臭氧(O3);猜想二:该气体为HCl;猜想三:该气体为Cl2
同学们认为不需要验证就可以判断猜想_____是错误的。理由是_____
(查阅资料)
(1)Cl2 +H2O=HCl +HClO;
(2)HCl +AgNO3=AgCl(白)↓ + HNO3;
(3)HClO具有强氧化性和漂白性,使有色物质褪色;
(4)臭氧在二氧化锰存在的情况下极易分解产生氧气。
(实验探究)
查阅资料后大家认为猜想一是错误的,理由是______________________________
他们为了验证剩下的猜想,继续做实验:
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 取氯酸钾和二氧化锰的混合物放入试管中加 热,将蘸有硝酸银溶液的玻璃棒伸入试管口 | _________________ | 剩下的猜想正确 |
2 | 再将湿润的蓝色石蕊试纸悬于试管口 | ______________ |
(反思与拓展)
(1)自来水厂常用漂白粉杀菌消毒﹝主要成分的化学式为Ca(ClO)2﹞。在水中起杀菌消毒作用的离子是___(填离子符号)
(2)MnO2不仅能作催化剂还可以作反应物,实验室通常用MnO2与浓盐酸共热制取Cl2,同时还生成MnCl2和一种常见的液体。请完成该反应的化学方程式:_____。
【题目】某化学兴趣小组获得两包制作“跳跳糖”的添加剂。一包是柠檬水晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了使澄清石灰水变浑浊的气体。为确定白色粉末的化学成分进行了以下探究:
(提出猜想)猜想1:碳酸钠;猜想2:碳酸氢钠;猜想3:碳酸钠和碳酸氢钠
(查阅资料)①碳酸钠溶液,碳酸氢钠溶液均呈碱性;
②碳酸氢钠受热分解生成碳酸钠,水和二氧化碳;碳酸钠受热不分解。
(实验探究)小亮,小刚分别对有关猜想设计方案并进行实验:
实验操作 | 实验现象 | 实验结论 | |
小亮 | 将白色粉末溶于水后pH试纸测定其酸碱度。 | pH__________(填“>”或“<”或“=”)7。 | 溶液呈碱性,猜想1成立。 |
小刚 | 用右图所示的装置进行实验。 | 试管A中有水珠产生,试管B中液体变浑浊。 | 猜想2成立,试管B中反应的化学方程式为__________。 |
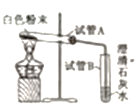
(实验质疑)
(1)小红认为小亮的实验结论不正确,理由是__________。(用文字叙述)
(2)小明认为小刚的实验并不能得出猜想2成立,理由是__________。(用文字叙述)
(实验探究2)
为了进一步确定白色粉末的化学成分,小威称取10g白色粉末与足量稀盐酸反应,充分反应后生成二氧化碳质量为mg。通过计算并分析实验数据确定猜想3成立,则m的取值范围为__________(计算结果用分数表示)。
(结论分析)
探究后他们查到该白色粉末的成分为碳酸氢钠。那么你认为白色粉末中的碳酸钠是如何产生的?写出产生碳酸钠的化学方程式__________。
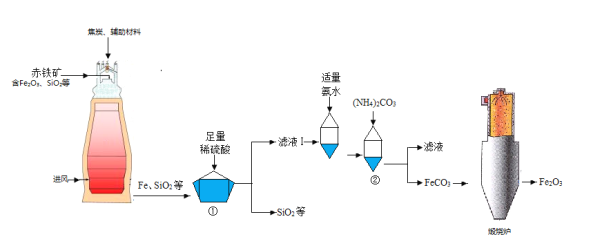
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
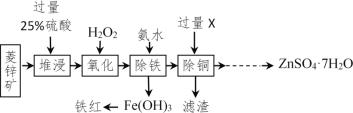
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。