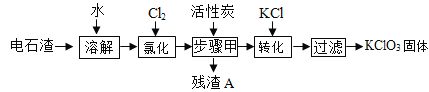
题目内容
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
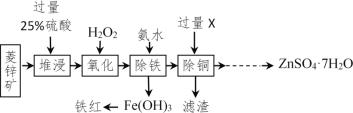
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
【答案】增大反应接触面积,让反应速率更快,反应更充分; ![]() 或51; 量筒; 搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅 锌或Zn, 置换; 2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O。 蒸发浓缩 b c; pH增大,除铁率提高 C 50, 3 .1。
或51; 量筒; 搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅 锌或Zn, 置换; 2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O。 蒸发浓缩 b c; pH增大,除铁率提高 C 50, 3 .1。
【解析】
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是:增大反应物的接触面积,加快反应的速率;
故填:增大反应接触面积,让反应速率更快,反应更充分;
(2)溶液稀释前后溶质质量不变 , 所以需要 98% 的硫酸质量为 200g×25%![]() 98% ,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,此处玻璃棒的作用是搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅;故填:200g×25%
98% ,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和量筒,此处玻璃棒的作用是搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅;故填:200g×25%![]() 98%或51;量筒;搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅
98%或51;量筒;搅拌,加速热量的扩散,防止局部温度过高造成暴沸或液滴飞溅
(3)锌和硫酸铜反应生成硫酸锌和铜,所以物质 X 是锌,除铜时发生的反应属于置换反应;故填:锌或Zn;置换
(4)硫酸亚铁、硫酸和过氧化氢在反应生成硫酸铁和水 , 化学方程式为: 2FeSO4+H2SO4+H2O2 ═ Fe2(SO4)3+2H2O ;故填:2FeSO4 + H2SO4 + H2O2====Fe2(SO4)3 + 2H2O
(5)获得七水硫酸锌前省略的操作是:蒸发浓缩、冷却结晶、过滤、洗涤和低温烘干;故填:蒸发浓缩
(6)①实验 b 和实验 c 对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;故填:bc
②实验 a 和实验 b 对比,得到结论是 pH 增大,除铁率提高;故填:pH 增大,除铁率提高;
③表中 Y 的值应该大于 95.1 ,小于 99.5 ,故选: C
④最佳的除铁条件为反应温度 50 ℃,溶液 pH3.1 ,除铁率最高。故填:50 , 3.1

【题目】兴趣小组的同学对铝的相关知识进行探究。
(知识回顾)
(1)铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。下列说法不正确的是 _____。
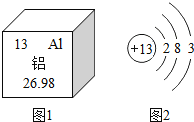
A 铝原子的中子数为13
B 铝离子核外有三个电子层
C 化合物中铝元素通常显+3价
D 铝可作导线是由于它具有良好的导电性
(铝的冶炼)
工业上常用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝,工艺流程如图。氧化铝是两性氧化物,与酸、碱都能发生反应,Al2O3+2NaOH=2NaAlO2+H2O。请回答以下问题:
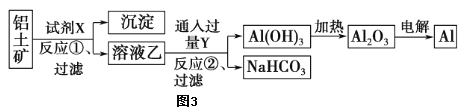
(2)试剂X是_________选填氢氧化钠溶液或盐酸)。
(3)反应①后过滤所得的沉淀是___________。
(4)写出反应②的化学方程式___________________。
(定性研究)
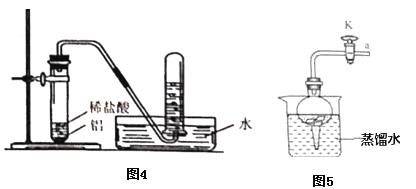
(提出问题)如图所示装置中铝和稀盐酸反应可以制取氢气,那么铝能否与水反应生成氢气呢?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(5)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。如生活中可用铝壶烧水。铝与氧气反应的化学方程式为_____________。
(6)除去铝表面氧化铝薄膜的方法有(举一例)_______。除上述方法外,还可以将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
(实验探究)
(7)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图),其表面生成大量气泡、周围出现白色沉淀。若关闭导管上的活塞K,反应停止,其原理是_____________。
(8)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)
(9)铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式____________。
(定量研究)兴趣小组取8g铝镁合金样品,将30g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
剩余固体的质量/g | 5.3 | 2.6 | 2.0 |
(10)该合金中,镁与铝的质量比为 _____。
(11)所用氢氧化钠溶液中溶质的质量分数为多少?(写出计算过程)____