题目内容
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液之间能否发生反应,将表中内容补充完整.
| | 氢氧化钠溶液 | 氯化钠溶液 | 碳酸钾溶液 | 硝酸钡溶液 |
| 稀硫酸 | 能反应 | 不能反应 | 能反应 | |
| 判断依据 | 有水生成 | 没有水、气体、沉淀生成 | | |
【实验方案】小丽同学设计实验方案进行探究,证明氢氧化钠溶液与稀硫酸发生了反应,请你和她一起完成实验报告.
| 实验操作 | 实验现象 |
| ①向试管中加入约2稀氢氧化钠溶液,滴加2滴 溶液 | |
| ②向①所得液体中滴加过量稀硫酸 | |
【实验拓展】小丽结合所学知识,认为初中常见的酸碱之间一定能发生复分解反应,她判断的依据是 .
【实验方案】 氢氧化钠溶液 氯化钠溶液 碳酸钾溶液 硝酸钡溶液 稀硫酸 能反应 不能反应 能反应 能反应 判断依据 有水生成 没有水、气体、沉淀生成 有气体和水生成 有沉淀生成
【实验拓展】酸与碱生成盐和水,符合复分解反应,只有当生成物中有沉淀或气体或水时,复分解反应才能够发生的条件实验操作 实验现象 ①向试管中加入约2稀氢氧化钠溶液,滴加2滴 酚酞溶液 溶液变为红色 ②向①所得液体中滴加过量稀硫酸 红色逐渐变浅至消失
解析

 阅读快车系列答案
阅读快车系列答案小红发现,金店里有两种不同的“白金”,单价相差悬殊,小红很好奇,打算进行研究。
【查阅资料】市场上所谓的“白金”通常有两种,一种是金、镍、铜、锌的合金,称为白色金;另一种是铂金,铂是一种银白色的贵重金属,用于耐腐蚀的化学仪器及首饰等,俗称“白金”,元素符号Pt。小红结合化学课上学习的金属活动性顺序,展开了下列实验活动。
(1)鉴别两种白金,她的方法可能是________________________;
(2)探究Zn、Ni(镍)、Cu的活动性顺序。
【做出假设】对三种金属的活动性顺序提出可能的假设①Zn>Ni>Cu;②Zn>Cu>Ni你觉得还有其他的可能性吗?请把它们写出来(一种即可)
假设:③______________________…………
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表所示,且得知镍能与酸反应。
| | OH- | NO3- | SO42- | Cl- |
| Ni2+ | 不 | 溶 | 溶 | 溶 |
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象。
【记录现象】请帮助小红把实验现象填写完整
| 金属 | Ni | Zn | Cu |
| 与盐酸反应的现象 | 气体产生缓慢, 金属逐渐溶解 | 气体产生迅速, 金属迅速溶解 | |
【得出结论】原假设中正确的是__________(填序号),写出镍与盐酸反应的化学方程式:___________________________。
【结论应用】①根据探究结果,请你预测镍与硫酸铜溶液____________(填“能”或“不能”)反应,理由是____________________。
②除小红的实验设计外,你能否像小红一样,设计另一组实验,也这样依次验证上述假设的正确与否,你的设计所用到的一组物质的化学式是__________(写出一组即可)。
早在春秋战国时期,我国就开始生产和使用铁器。
(1)写出用CO和赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式 ,盛水的铁锅与水面接触的一圈最易生锈,钢铁生锈的条件是 ,利用新技术能将不锈钢加工成柔软的金属丝,这是利用了不锈钢的 (填字母)。
| A.耐腐蚀性 | B.延展性 | C.导热性 | D.导电性 |
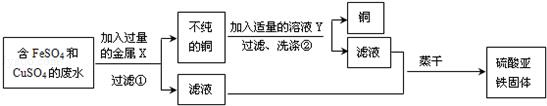
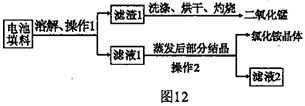
金属X是 ,写出上述实验方案中有关反应的化学方程式
① ;② 。
(12分)碱式碳酸盐广泛应用于工农业生产。
(1)某碱式碳酸盐样品M(OH)2·MCO3,为确定金属M的相对原子质量,某研究小组设计如下实验装置及步骤(不考虑植物油中溶解CO2产生的影响)。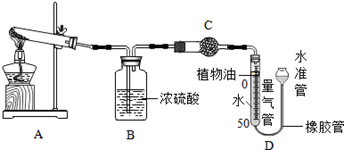
①连接装置并 ;②准确称量样品的质量;③装药品,调节量气装置两边液面相平,读数;④加热至样品质量不再减少;⑤冷却到室温;⑥调节量气装置两边液面相平,读数、列式计算。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是 ,少量植物油的作用是 ,C中的试剂是 (填字母序号);
a.碱石灰 b.浓硫酸 c.硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管 (填“缓慢上移”或“缓慢下移”)。
Ⅳ.若其他操作均正确,仅因下列因素可使M相对原子质量的测定结果偏大的是 (填字母序号);
a.反应前量气管水面在0刻度处,反应后仰视读数
b.样品未分解完全即停止实验
c.量气管中未加植物油
(2)实际生产中的碱式碳酸铜可表示为Cu(OH)2·mCuCO3,某研究小组仍使用上述装置测定m的值,测得3组数据如下表所示。取3组数据的值得到CO2的体积为 mL,又知常温常压下CO2的密度为1.964 g/L,据此计算m的值。(写出计算m的过程,最后结果保留小数点后两位) 。
| 组别 | 样品质量 | CO2体积 |
| 第1组 | 0.21 g | 22.39 mL |
| 第2组 | 0.21 g | 22.41 mL |
| 第3组 | 0.21 g | 22.40 mL |
燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:
请回答下列问题:
(1)二氧化硫中硫的化合价是 。
(2)用熟石灰中和稀硫酸的化学方程式是 。
(3)亚硫酸(H2SO3)被空气中氧气氧化为硫酸,写出反应的化学方程式 。
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比——与温度、烟气中SO2浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g·L-1 | 脱硫率/% |
| I | 23 | 2.5% | 99.5 |
| II | 23 | 3.2% | 97.1 |
| III | 40 | 2.5% | 94.3 |
(5)目前,科学家正在研究在一定条件下将乙烯(C2H4)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:O2与Cu+反应生成Cu+(O2)
第二步:Cu+(O2)与SO2反应生成Cu+(SO3)2
第三步:Cu+(SO3)2与C2H4反应生成S、CO2、H2O和Cu+。
①反应中Cu+的作用是 。
②除去二氧化硫的总反应的化学方程式是 。

 (5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。