题目内容
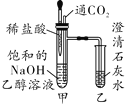
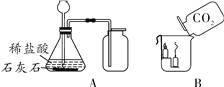
【题目】实验小组的同学研究二氧化碳的性质,实验方案如下。注:乙醇在实验中只作溶剂,不参与化学反应。
实验装置 | 实验操作 | 实验现象 |
| ||
①向饱和 的NaOH乙醇溶液中缓慢通入CO2 | 甲中出现胶状白色沉淀,乙中无明显现象 | |
②滴入稀盐酸 | 甲中有气泡生成,乙中澄清石灰水变浑浊 |
(1)实验操作①中,甲内发生反应的化学方程式为_________。
(2)甲中出现胶状白色沉淀的原因是______________。
(3)实验操作②的目的是_____________。
(4)如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,____(填“能”或“不能”)完成实验目的。
【答案】 2NaOH+CO2=== Na2CO3+H2O 碳酸钠在乙醇中的溶解度小 证明甲中有Na2CO3生成 能
【解析】(1)根据二氧化碳与氢氧化钠的反应分析解答;(2)根据甲中出现胶状白色沉淀分析碳酸钠的溶解性;(3)根据实验的过程及现象分析实验目的;(4)根据二氧化碳与氢氧化钠的反应生成碳酸钠,碳酸钠能与盐酸反应生成二氧化碳分析解答。(1) 二氧化碳与氢氧化钠反应生成碳酸钠和水,实验操作①中,甲内发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O;(2)甲中出现胶状白色沉淀的原因是碳酸钠在乙醇中的溶解度小;(3)应为碳酸钠能与盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以实验操作②的目的是证明甲中有Na2CO3生成;(4)因为二氧化碳与氢氧化钠的反应生成碳酸钠,碳酸钠能与盐酸反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊。所以如果将上述实验方案中的氢氧化钠乙醇溶液换为氢氧化钠水溶液,能完成实验目的。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目