题目内容
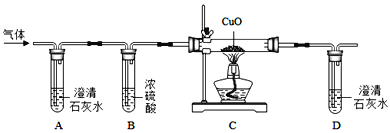
【题目】已知草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为: H2C2O43H2O  CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
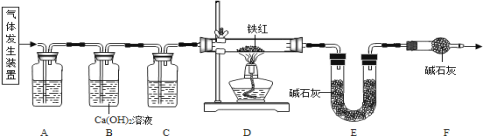
(1)下列可用作草酸分解制取气体的装置是__________(填字母编号)

(2)写出D装置中一氧化碳还原氧化铁的化学方程式____________。
(3)称取质量为m的铁红样品,用上述装置进行实验,测定铁红中铁的质量分数。
①反应结束后D中得到Fe粉的质量x,则x的取值范围为____________(用m的代数式表示)。
②若充分反应后,称得E装置增重n,则此铁红中铁的质量分数是_________(用m、n的代数式表示)。
(4)关于该实验,下列说法正确的是_____________。
①进入D中的气体是纯净、干燥的CO,则A、C中的试剂分别是浓硫酸和澄清石灰水
②对D装置加热前和停止加热后,都要通入过量的CO,其作用都是防止爆炸
③装置F的作用是防止空气中的二氧化碳和水蒸气进入到装置E中
④实验装置有一明显的缺陷是没有尾气处理装置
⑤若没有装置C,则测定的铁元素的质量分数会偏大
【答案】b Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2 ![]() <x<
<x<![]() 1-
1-![]() ×100% ②③④
×100% ②③④
【解析】
(1)制取一氧化碳的反应物的状态是固体和液体,反应的条件是不加热,故选固液不加热型装置b。
(2)一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应的方程式为: Fe2O3+3CO ![]() 2Fe+3CO2.
2Fe+3CO2.
(3)①由化学式Fe2O3、FeO、Fe3O4可知,FeO中铁元素的质量分数最高,Fe2O3中铁元素的质量分数最低,故x大于m×![]() ,小于m×
,小于m×![]() ,故填
,故填![]() <x<
<x<![]()
②若充分反应后,称得E装置增重n,说明生成二氧化碳的质量为n。二氧化碳中氧元素的质量一半来自于铁红中,故铁红中氧元素的质量为:![]() =
=![]() ,则铁红中氧元素的质量分数为:
,则铁红中氧元素的质量分数为:![]() ÷m×100%=
÷m×100%=![]() ×100%,故铁红中铁元素的质量分数为:1-
×100%,故铁红中铁元素的质量分数为:1-![]() ×100%。
×100%。
(4)①进入D中的气体是纯净、干燥的CO,则A、C中的试剂分别是浓硫酸和澄清石灰水
②一氧化碳不纯点燃会发生爆炸,故对D装置加热前和停止加热后,都要通入过量的CO,其作用都是防止爆炸,正确;
③该实验通过测定E装置中质量的增加量来确定生成二氧化碳的质量,故装置F的作用是防止空气中的二氧化碳和水蒸气进入到装置E中,正确;
④实验装置有一明显的缺陷是没有尾气处理装置,正确;
⑤装置C是除去水的装置,若没有装置C,则E装置中增加的质量n偏大,根据铁红中铁元素的质量分数为:1-![]() ×100%,故测定的铁元素的质量分数会偏小,故错误。故选②③④.
×100%,故测定的铁元素的质量分数会偏小,故错误。故选②③④.

【题目】下列实验方法能达到实验目的的是( )
选项 | 实验目的 | 实验方法 |
A | 除去 | 加入足量锌粉 |
B | 检验一瓶气体是否为 | 将燃着的木条伸入瓶中 |
C | 检验蜡烛燃烧的产物中是否有水 | 在火焰上方罩一只冷而干燥的烧杯 |
D | 分离铜粉和铁粉 | 加水,过滤 |
A. A B. B C. C D. D