题目内容
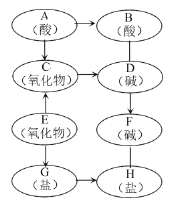
【题目】金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成份FeTiO3)制取钛并获得副产品A的主要工艺流程如下:(反应①②均为分解反应)
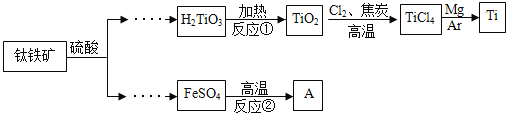
(1)反应①生成了两种氧化物,化学方程式为________。
(2)TiO2与焦炭和Cl2在高温下反应,该反应中C和Cl2按质量比为12: 71的比例参加反应,相应的化学方程式为__________。
(3)反应②产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,化学方程式为__________。
【答案】H2TiO3![]() H2O+TiO2 TiO2+2C+2Cl2
H2O+TiO2 TiO2+2C+2Cl2![]() TiCl4+2CO 2FeSO4
TiCl4+2CO 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
【解析】
(1)反应①中,H2TiO3分解生成两种氧化物,根据质量守恒定律和氧化物的概念,可知,H2TiO3分解生成水和二氧化钛,反应的化学方程式为:H2TiO3![]() H2O+TiO2;
H2O+TiO2;
(2)该反应中C和Cl2按质量比为12:71的比例参加反应,碳和氯气的化学方程式中化学计量数之比为:![]() ,流程图中提示有TiCl4生成,相应的化学方程式为:TiO2+2C+2Cl2
,流程图中提示有TiCl4生成,相应的化学方程式为:TiO2+2C+2Cl2![]() TiCl4+2CO;
TiCl4+2CO;
(3)反应②中的红色固体是氧化铁,两种组成元素相同且相对分子质量相差16的气体是二氧化硫和三氧化硫,则该反应的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。

 阅读快车系列答案
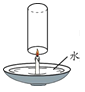
阅读快车系列答案【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,发现钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)(提出问题)黑色颗粒和白色物质是什么?
(进行猜想)甲认为黑色颗粒是炭粒,白色物质可能是Na2O或_____;乙同学还认为白色物质是氢氧化钠。甲同学立刻认为乙同学的猜想是错误的,其理由是____。
(2)(查阅资料)①Na2O为白色固体,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH;②CaCl2溶液显中性。
(实验探究)甲同学对白色物质进行实验探究。
实验方案 | 实 验 操 作 | 实验现象 | 结 论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质是____。 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(3)(反思评价)丙同学认为方案1得到的结论不正确,理由是____。
(4)(得出结论)钠在二氧化碳中燃烧的化学方程式为____。
(5)(思维托展)通过以上探究,你还能获得哪些结论,请写出一条____。