题目内容
【题目】在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中碳酸钙的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10g置于烧杯中,将烧杯放在电子天平上,往烧杯中平均分5次加入50g的稀盐酸,测得实验数据如表:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
剩余物质质量/g | 19.0 | 28.0 | 37.0 | 46.7 | 56.7 |
(1)第__________ 次实验时鸡蛋壳已经完全反应。
(2)假定鸡蛋壳中的其它物质不会与稀盐酸反应,试计算出该鸡蛋壳中碳酸钙的质量分数________。(写出具体计算过程)
(3)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系________(标注必要的数值)
【答案】(1)4 (2)设该鸡蛋壳中碳酸钙的质量分数为x:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
10gx 3.3g
![]()
x=75%
该鸡蛋壳中碳酸钙的质量分数为75% (3)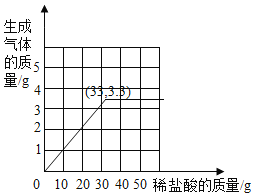
【解析】
(1)根据前三次每加入10g盐酸物质减少1g,而第四次只减少了0.3g,说明此时碳酸钙已经完全反应,生成的二氧化碳的质量为10g+10.0g×3-46.7g=3.3g;
(2)根据二氧化碳的质量和对应的化学方程式求算该鸡蛋壳中碳酸钙的质量分数;
(3)根据每加入10g盐酸物质减少1g,则生成3.3g二氧化碳对应盐酸为33g。得图:


练习册系列答案
 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目