题目内容
【题目】实验课上,某小组同学取52g过氧化氢溶液与2g二氧化锰混合制取氧气,充分反应后,测得剩余物质总质量为50.8g。
(1)该反应的微观实质是_____。
(2)请计算参加反应的过氧化氢的质量____。
【答案】过氧化氢分子分成氢原子和氧原子,氮原子和氧原子又结合成水分子和氧分子 6.8g
【解析】
(1).化学反应过程就是旧的分子分子分成原子,原子再重新组合成新的分子。所以过氧化氢分解的微观实质是过氧化氢分子分成氢原子和氧原子,氮原子和氧原子又结合成水分子和氧分子;
(2)据质量守恒定律可知,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。所以生成氧气的质量为:52g+2g-50.8g=3.2g,
设参加反应的过氧化氢的质量为x
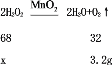
![]() x=6.8g
x=6.8g
答:参加反应的过氧化氢的质量为6.8g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中碳酸钙的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10g置于烧杯中,将烧杯放在电子天平上,往烧杯中平均分5次加入50g的稀盐酸,测得实验数据如表:
实验次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
剩余物质质量/g | 19.0 | 28.0 | 37.0 | 46.7 | 56.7 |
(1)第__________ 次实验时鸡蛋壳已经完全反应。
(2)假定鸡蛋壳中的其它物质不会与稀盐酸反应,试计算出该鸡蛋壳中碳酸钙的质量分数________。(写出具体计算过程)
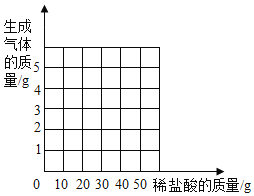
(3)请在图中画出加入稀盐酸的质量与生成气体的质量的变化关系________(标注必要的数值)