题目内容
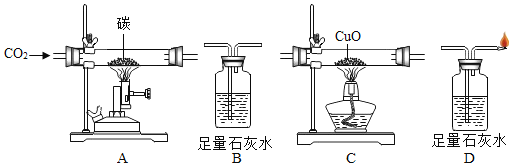
【题目】根据下列装置,结合所学化学知识回答下列问题.
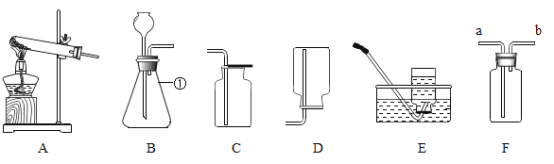
(1)写出标号仪器①的名称:________;
(2)实验室选择装置A用高锰酸钾制取氧气时,你认为A装置存在的问题是________,选择收集装置应依据氧气________的性质,该反应的化学方程式是_______;
(3)通常情况下,SO2是一种无色、有刺激性气味的气体,密度比空气大,易溶于水且水溶液显酸性.实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2.实验室制取SO2选择的发生装置是______(填字母),若选择F装置收集SO2,气体应该从_____口(填“a”或“b”)进入,实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是_______.
【答案】锥形瓶 试管口没有放棉花团 密度和溶解性 2KMnO4![]() K2MnO4+MnO2+O2↑ B a 防止二氧化硫污染空气
K2MnO4+MnO2+O2↑ B a 防止二氧化硫污染空气
【解析】
(1)据常用仪器回答;
(2)加热高锰酸钾制 取氧气时,试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管,收集装置据气体密度和溶解性选择,并据反应原理书写方程式;
(3)用亚硫酸钠固体和浓硫酸反应制取SO2,属于固液常温型,故选发生装置B,二氧化硫密度比空气大,所以应从长管进气,吸收二氧化硫的目的是:防止二氧化硫污染空气。
(1)锥形瓶是常用的反应容器,故填:锥形瓶。
(2)加热高锰酸钾时,试管口要放一团棉花,是为了防止高锰酸钾粉末进入导管;选择收集装置应依据氧气密度和溶解性;高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,方程式是![]() ,故填:试管口没有放棉花团;密度和溶解性;
,故填:试管口没有放棉花团;密度和溶解性;![]() 。
。
(3)实验室里,用亚硫酸钠固体和浓硫酸反应制取SO2,属于固液常温型,故选发生装置B;若选择F装置收集SO2,气体应该从长管进入即a口,因为二氧化硫的密度比空气的密度大;实验结束后剩余的SO2气体用氢氧化钠溶液吸收,吸收的目的是:防止二氧化硫污染空气;故填:B;a;防止二氧化硫污染空气。