题目内容
【题目】现有含氧元素的质量分数为32%的氧化镁、氧化铜组成的混合物40g,与100g硫酸溶液恰好完全反应,则该硫酸溶液中氢元素的质量分数为( )
A.2%B.4%C.10%D.19.6%
【答案】B
【解析】
由于氧化铜和氧化镁的混合物与100g硫酸溶液恰好完全反应,分析化学方程式CuO+H2SO4=CuSO4+H2O,MgO+H2SO4=MgSO4+H2O,可知氧化物中氧元素全部转变为水中的氧元素,生成水中氢元素全部来自硫酸即可;氧化镁、氧化铜组成的混合物中氧元素的质量是40g×32%=12.8g,设硫酸溶液中硫酸的质量为x,其中氢元素的质量为y,由化学方程式可以看出氧化镁、氧化铜组成的混合物中氧元素、硫酸、生成水以及氢元素的关系为:
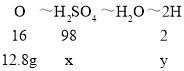
![]()
x=78.4g,y=1.6g,
该硫酸溶液中水的质量为100g﹣78.4g=21.6g,其中氢元素的质量为21.6g×![]() ×100%=2.4g,则该硫酸溶液中氢元素的质量分数为
×100%=2.4g,则该硫酸溶液中氢元素的质量分数为![]() ×100%=4%。
×100%=4%。
故选B。

练习册系列答案
相关题目