题目内容
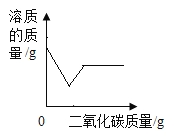
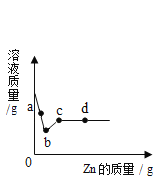
【题目】已知M物质的溶解度随温度升高而增大。将80gM物质加入50g水中,充分溶解,所得溶液质量如图所示。A点时,该溶液的溶质质量分数为_____;将B点对应的溶液中加入70g水,所得溶液的溶质质量分数是_____;C点所对应的溶液是_____〔填“饱和”或“不饱和”)溶液。
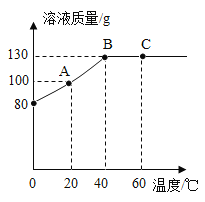
【答案】50% 40% 不饱和
【解析】
根据坐标曲线可知,A点时,溶液的质量为100g,溶剂的质量为50g,故溶质的质量为50g,溶质质量分数是![]() ×100%=50%;
×100%=50%;
B点时,溶液的质量为130g,溶剂的质量是50g,溶质的质量是80g,在B点对应的溶液中加入70g水,此时溶液的质量为130g+70g=200g,此时溶液的溶质质量分数是
![]() ×100%=40%;
×100%=40%;
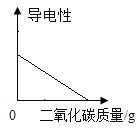
由于M物质的溶解度随温度升高而增大,40℃时,M物质完全溶解,升高温度到60℃,溶液为不饱和溶液,故C点的溶液是不饱和溶液。

【题目】某小组用干电池、生石灰等仪器和试剂进行电解水的实验改进与探究。
实验一:探究干电池构造:酸性锌锰干电池内部结构如图所示,小组同学取出铜片、碳棒、锌皮和黑色糊状填充物。并查阅资料知道了其中的黑色糊状填充物由炭黑、MnO2、ZnCl2和另一种氯化物等组成。
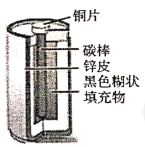
(1)将黑色糊状填充物溶于水, __________________(填操作名称)得到溶液和固体,用石蕊试纸检验溶液呈红色,表明溶液呈__________________性。
(2)在溶液中加入生石灰,能闻到强烈的氨味,生石灰与水反应的化学方程式为__________________,黑色糊状填充物中另一种氯化物的化学式为__________________。
(3)从得到的固体中得到较纯的MnO2,可采用的简便方法是__________________。
(4)将6.5g锌皮与足量稀盐酸完全反应,则生成氢气的质量大于0.2g,由此推测锌皮还可能含的另外一种金属是______________。 (填答案字母序号)
a 锡
b 铁
c 铅
实验二:电解水的实验改进用电池中取出的碳棒作电极,用生石灰制成的Ca(OH)2饱和溶液增强水的导电性,进行电解水的实验。实验时除两个电极均有气泡冒出外,溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
[猜想与假设]
①溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②水减少导致Ca(OH)2析出而出现白色浑浊。
③与碳棒电极材料有关。
[实验操作]
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | 取20mLCa(OH)2饱和溶液加热至沸腾 | 溶液中未出现白色浑浊 | |
2 |
| 用碳棒为电极,取饱和溶液于烧杯中,加5mL水,通电3分钟 | 烧杯中溶液体积几乎无明显变化,溶液中明显出现白色浑浊 |
3 | 改用铜片为电极,另取饱和溶液于烧杯中,加5ml水通电3分钟 | 与电源正极相连的铜电极变黑, 溶液中未出现白色浑浊 |
[解释与结论]
(5)实验1得出的结论是_______________________。
(6)猜想与假设②不成立,依据的现象是______________________。
(7)实验3中铜电极上的黑色物质是_______________________,要除去该物质需要的试剂是__________________。(填化学式)
[结论与反思]
(8)通过探究过程,用石墨做电极进行实验时,Ca(OH)2溶液中出现白色浑浊的原因是______________________。(用化学方程式表示)
(9)实验3中更换石墨电极为铜电极的目的是_______________________。