题目内容
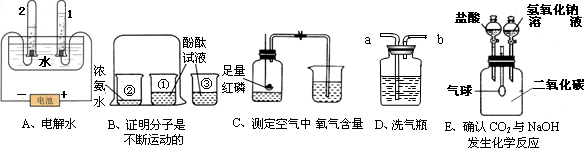
(6分)请根据下图所示实验,回答问题。
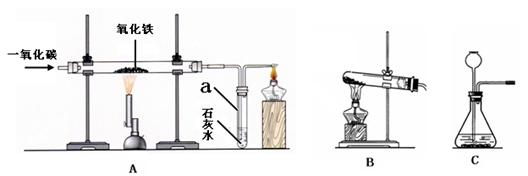
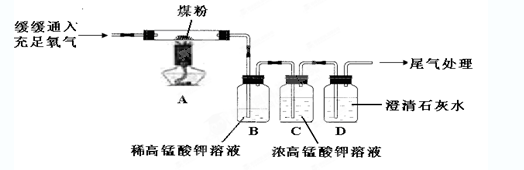
(1)A中仪器a的名称是 。玻璃管中的现象是 ,反应的化学方程式为 。
(2)B装置可用于高锰酸钾制氧气,反应的化学方程式为 。
(3)实验室用C装置制取CO2,反应的化学方程式为 。
(4)二氧化碳的收集方法与氧气不完全相同,原因是 。

(1)A中仪器a的名称是 。玻璃管中的现象是 ,反应的化学方程式为 。
(2)B装置可用于高锰酸钾制氧气,反应的化学方程式为 。
(3)实验室用C装置制取CO2,反应的化学方程式为 。
(4)二氧化碳的收集方法与氧气不完全相同,原因是 。
(1)试管 ;红色固体变为黑色 ;3CO+Fe2O3 3CO2+2Fe
3CO2+2Fe
(2)2KMnO4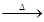 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)CaCO3+2HCl =" CaCl" 2+CO2↑+H2O
(4)二氧化碳能溶于水,不能用排水法收集,而氧气不易溶于水,所以能用排水法收集。
 3CO2+2Fe
3CO2+2Fe(2)2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑(3)CaCO3+2HCl =" CaCl" 2+CO2↑+H2O
(4)二氧化碳能溶于水,不能用排水法收集,而氧气不易溶于水,所以能用排水法收集。
试题分析:(1)A中仪器a是试管;由于通入的CO具有还原性,在高温下能够把红色的氧化铁还原为黑色的铁,故可见玻璃管中的现象是红色固体变为黑色;则反应的化学方程式为3CO+Fe2O3
 3CO2+2Fe。
3CO2+2Fe。(2)高锰酸钾在加热的条件下,可分解生成锰酸钾、二氧化锰和氧气,则反应的化学方程式为2KMnO4△
K2MnO4+MnO2+O2↑。
(3)C装置适用于固-液不加热反应,可用大理石或石灰石与稀盐酸反应制取二氧化碳,故反应的化学反应式为CaCO3+2HCl=CaCl2+CO2↑+H2O。
(4)收集气体要看气体的密度和水溶性,由于二氧化碳能溶于水,故不能用排水法收集,而氧气不易溶于水,所以能用排水法收集。
点评:本题主要考查的是化学方程式的书写和常用气体的收集方法,书写化学方程式时,要遵循反应事实和质量守恒定律,严格按“写、配、标、注”的步骤书写;对于常用气体的发生装置和收集装置的选取方法,要学会根据反应物的状态和反应的条件选择发生装置,根据制取气体的溶解性和密度的大小选择收集气体的方法。

练习册系列答案
相关题目


 时间/s
时间/s