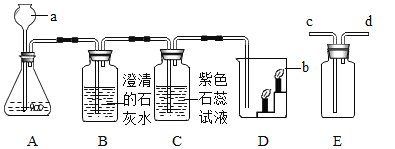
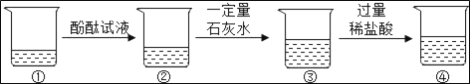
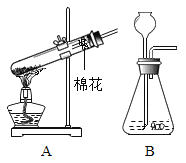
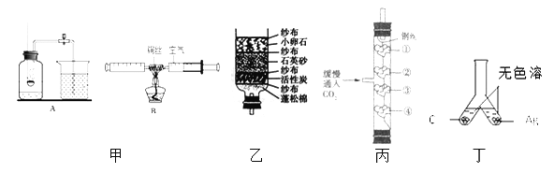
题目内容
【题目】将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物X。测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是
A.表中m的值为13.5B.该反应属于分解反应
C.物质X能在氧气中燃烧D.物质X中一定含有氢元素
【答案】C
【解析】
由表格信息可知反应后CO2质量增加了6.6g,是生成物;H2O质量增加了2.7g,是生成物;O2质量减少了9.6g,是反应物;苯的质量减少了3.9g克,是反应物;生成物还少4.2g,所以X是生成物。
A、反应后生成的物质X的质量4.2g,故m的值为4.2g,故A错误。
B、反应物是苯和O2,生成物是CO2、H2O和X,不是分解反应,故B错误。
C、根据反应前后元素质量相等,苯中含碳元素的质量为![]() ,二氧化碳中含有碳元素的质量为
,二氧化碳中含有碳元素的质量为![]() ,物质X含有碳元素的质量为3.6g﹣1.8g=1.8g。苯中含氢元素的质量为
,物质X含有碳元素的质量为3.6g﹣1.8g=1.8g。苯中含氢元素的质量为![]() ,2.7g水中含氢元素的质量为
,2.7g水中含氢元素的质量为![]() ,反应前后氢元素的质量相等,故X不含有氢元素。则X中含氧元素的质量为:4.2g﹣1.8g=2.4g;X中含有C、O两种元素,两种元素的质量比为1.8g:2.4g=3:4,该物质为CO,具有可燃性,能在氧气中燃烧生成二氧化碳。故选C正确。
,反应前后氢元素的质量相等,故X不含有氢元素。则X中含氧元素的质量为:4.2g﹣1.8g=2.4g;X中含有C、O两种元素,两种元素的质量比为1.8g:2.4g=3:4,该物质为CO,具有可燃性,能在氧气中燃烧生成二氧化碳。故选C正确。
D、由C中计算过程可知:X中只含有C、O两种元素,故D错误。
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后_____和_____不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
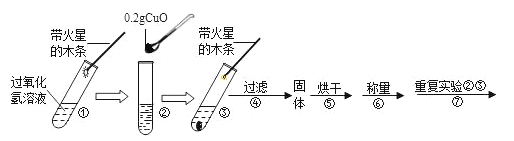
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____, 带火星的木条复燃 | 所得固体 _____g | 溶液中有气泡放出, _____ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为_____。