题目内容
【题目】兴趣小组的同学对铝的相关知识进行探究。
(知识回顾)
(1)铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。下列说法不正确的是 _____。
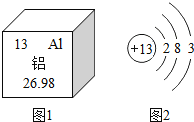
A 铝原子的中子数为13
B 铝离子核外有三个电子层
C 化合物中铝元素通常显+3价
D 铝可作导线是由于它具有良好的导电性
(铝的冶炼)
工业上常用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝,工艺流程如图。氧化铝是两性氧化物,与酸、碱都能发生反应,Al2O3+2NaOH=2NaAlO2+H2O。请回答以下问题:
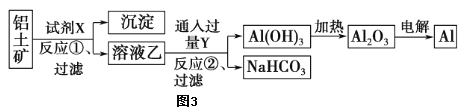
(2)试剂X是_________选填氢氧化钠溶液或盐酸)。
(3)反应①后过滤所得的沉淀是___________。
(4)写出反应②的化学方程式___________________。
(定性研究)
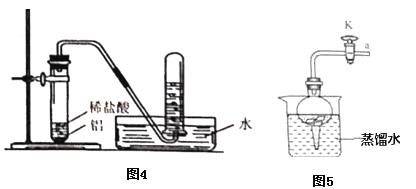
(提出问题)如图所示装置中铝和稀盐酸反应可以制取氢气,那么铝能否与水反应生成氢气呢?
(查阅资料)
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
(交流与讨论)
(5)铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,起到保护膜的作用。如生活中可用铝壶烧水。铝与氧气反应的化学方程式为_____________。
(6)除去铝表面氧化铝薄膜的方法有(举一例)_______。除上述方法外,还可以将铝片浸入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。
(实验探究)
(7)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图),其表面生成大量气泡、周围出现白色沉淀。若关闭导管上的活塞K,反应停止,其原理是_____________。
(8)在导管口a处涂肥皂水,发现导管口有气泡形成,当气泡离开导管后,气泡______(填“下沉”或“上升”),用燃着的木条点燃气泡,发出爆鸣声。
(实验结论)
(9)铝能与水反应生成氢气。写出铝与水反应生成氢氧化铝和氢气的化学方程式____________。
(定量研究)兴趣小组取8g铝镁合金样品,将30g氢氧化钠溶液平均分成三份依次加入样品中(镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下:
所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
剩余固体的质量/g | 5.3 | 2.6 | 2.0 |
(10)该合金中,镁与铝的质量比为 _____。
(11)所用氢氧化钠溶液中溶质的质量分数为多少?(写出计算过程)____
【答案】AB 氢氧化钠溶液 Fe2O3 NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 4Al+3O2=2Al2O3 用砂纸打磨 关闭活塞K,容器内压强增大,把液体压回烧杯,固体与液体分离,反应停止 上升 4Al+6H2O=2Al(OH)3+3H2↑ 1:3 40%
【解析】
(1) A、根据图1可知,铝原子的质子数为13,故A错误;
B、根据图2可知,铝原子核外有三个电子层,故B错误;
C 铝原子的最外层电子数为3,在化学变化中容易失去3个电子,在化合物中铝元素通常显+3价,正确;
D 铝可作导线是由于它具有良好的导电性,正确;
[铝的冶炼]
(2)氧化铝是两性氧化物,与酸、碱都能发生反应,杂质氧化铁能与酸反应,不能与碱反应,试剂X选用氢氧化钠溶液;
(3)氧化铝是两性氧化物,与酸、碱都能发生反应,杂质氧化铁能与酸反应,不能与碱反应,反应①后过滤所得的沉淀是Fe2O3;
(4)反应②的化学方程式NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
[交流与讨论]
(5)铝与氧气反应的化学方程式为4Al+3O2=2Al2O3;
(6)除去铝表面氧化铝薄膜的方法有用砂纸打磨;
[实验探究]
(7)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右,取出,立即用流水冲洗干净后加入到蒸馏水中(如图5),其表面生成大量气泡、周围出现白色沉淀。若关闭导管上的活塞K,反应停止,其原理是:关闭活塞K,容器内压强增大,把液体压回烧杯,固体与液体分离,反应停止;
(8)导管口a生成的是氢气,氢气密度比空气小,a处涂肥皂水,当气泡离开导管后,气泡上升;
[实验结论]
(9)铝与水反应生成氢氧化铝和氢气的化学方程式为:4Al+6H2O=2Al(OH)3+3H2↑;
[定量研究]
(10)剩余固体的质量2g为金属镁,金属铝的质量为8g-2g=6g,故该合金中,镁与铝的质量比为2:6=1:3;
(11)解:设10g氢氧化钠溶液中溶质的质量为x
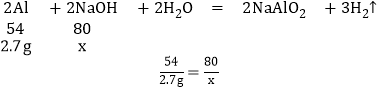
x=4g
所用氢氧化钠溶液中溶质的质量分数为![]() 。
。

【题目】铁与水蒸气在高温条件下反应生成了一种铁的氧化物和一种气体单质,实验装罝如下图所示。
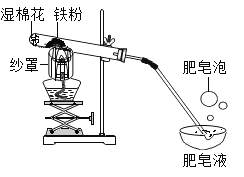
(1)试管尾部放一团湿棉花的目的是__________。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空气中。说明生成的气体是__________。
(3)探宄试管中剩余固体的成分。
(査阅资料)
①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe304 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色品体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:
Fe304+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)
试管中剩余间体为黑色,能全部被磁铁吸引,则剩余固体一定不含氧化物__________、__________。
(猜想与假设)
猜想一:剩余固体是Fe304;
猜想二:剩余固体是__________。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____________。 | 猜想一不成立, 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为____________________。
【题目】以菱锌矿(主要成分是ZnCO3,杂质为Fe2O3、FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
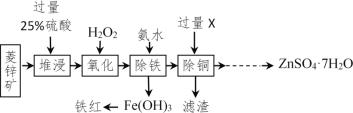
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是_____________________;
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要98%的硫酸质量为_____g(列出算式即可),需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和________,此处玻璃棒的作用是____;
(3)物质X是___________,除铜时发生的反应属于________________反应(填基本反应类型);
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式:_______________。
(5)流程中获得七水硫酸锌前省略的操作是______________、冷却结晶、过滤、洗涤和低温烘干;
(6)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
编号 | 反应温度/℃ | 溶液pH | 除铁率/% |
a | 30 | 2 | 91.5 |
b | 30 | 2.5 | 93.3 |
c | 40 | 2.5 | 95.1 |
d | 40 | 3.1 | Y |
e | 50 | 3.1 | 99.5 |
①实验____和实验_____对比,得到的结论为其他条件不变时,反应温度增大,除铁率提高;
②实验a和实验b对比,得到结论是____________;
③表中Y的值可能为_____________(填编号)
A 93.4 B 94.1 C 97.8 D 99.6
④最佳的除铁条件为反应温度______℃,溶液pH_________。
【题目】现有下列仪器或装置,请回答下列问题:
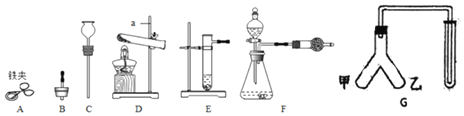
①仪器a的名称是______:用______![]() 填仪器名称
填仪器名称![]() 取废铁屑放入试管,可以用图A~E仪器组装成制取气体的发生装置:用废铁屑与稀盐酸反应制取H2,应选______
取废铁屑放入试管,可以用图A~E仪器组装成制取气体的发生装置:用废铁屑与稀盐酸反应制取H2,应选______![]() 填字母
填字母![]() ,写出反应的化学方程式:______。
,写出反应的化学方程式:______。
②选择气体收集方法时,必须考虑的气体性质有______![]() 填序号
填序号![]() 。
。
A 颜色 B 密度 C 溶解性 D 可燃性
③向“人”字型管G装置![]() 端分别装入一种固体和一种液体物质,按图示连接好装置,再倾斜装置,使乙中液体流入甲中。填写下表。
端分别装入一种固体和一种液体物质,按图示连接好装置,再倾斜装置,使乙中液体流入甲中。填写下表。
操作及现象 | 所装固体物质和液体物质 | 两端物质反应的化学方程式 |
将带火星木条放在试管口,木条复燃 | ______ | ______ |
将燃着木条放在试管口,木条熄灭 | ______ | ______ |
④若要检验F装置中产生的气体中是否含有水蒸气,干燥管中应该装入的物质是______。
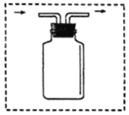
⑤若用如图装置且正放在桌上进行“排空气法”收集制取的H2,请把图中的“导气管”补画完整_____。
【题目】等质量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t内产生气体体积V的数据,根据数据绘制得到图1。
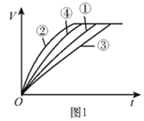
组别 | 盐酸的溶质质量分数/% | 温度/℃ |
① | 7 | 30 |
② | 10 | 50 |
③ | 7 | 20 |
④ | 10 | 30 |
(1)请写出铁粉与稀盐酸反应的化学方程式:________。
(2)通过实验①③对比,得出的结论是________;要比较盐酸的溶质质量分数对反应快慢的影响,应选择的实验组别是________。
(3)实验中产生气体“逐渐变快又变慢”的原因是________。
(进一步探究)图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与20 mL 10%的稀盐酸反应产生氢气的量(产生氢气的量由气体压强表示,在等温条件下,产生氢气的体积与装置内压强成正比)。
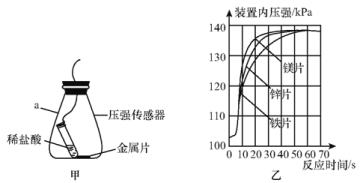
①实验中你认为还要控制的变量是________。
②根据图乙,你得出的反应物的量与生成的气体体积的关系是________。
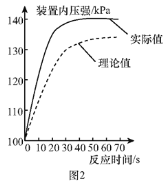
(拓展提高)图2为测得的室温下足量的镁片与20 mL 10%的稀盐酸反应产生氢气的量与时间的关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点):
①________;②________。
