题目内容
【题目】(1)下列物质中,属于纯净物的是____(填写序号,下同),属于化合物的是_____.
①液态氧②蒸馏水③干冰④天然气⑤过磷酸钙
(2)用离子符号表示:①三个钙离子_____;②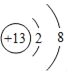 表示的是_____.
表示的是_____.
(3)用化学方程式解释:盐酸可以除去铁制品表面的铁锈(Fe2O3)_____.该反应的基本反应类型是_____.
【答案】①②③ ②③ 3Ca2+ Al3+ Fe2O3+6HCl═2FeCl3+3H2O 复分解反应
【解析】
纯净物是由一种物质组成的物质;混合物是由多种物质组成的物质;单质是由同种元素组成的纯净物;化合物是由不同种元素组成的纯净物。元素符号前面的数字表示微粒个数,在元素符号右上角的数字表示电荷数,“+”表示正电荷;首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可。
(1)天然气的主要成分是甲烷,属于混合物.过磷酸钙中含有磷酸二氢钙和硫酸钙,属于混合物;①液态氧、②蒸馏水、③干冰都是由一种物质组成的,都属于纯净物.蒸馏水、干冰都是由不同种元素组成的纯净物,都属于化合物;故填:①②③;②③
(2)钙的元素符号为Ca,元素符号前面的数字表示微粒个数,在元素符号右上角的数字表示电荷数,“+”表示正电荷,则三个钙离子可用3 Ca2+表示;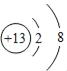 的核内质子数大于核外电子数,因此表示的是铝离子;故填:3Ca2+ ;Al3+
的核内质子数大于核外电子数,因此表示的是铝离子;故填:3Ca2+ ;Al3+
(3)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O;该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。故填:Fe2O3+6HCl═2FeCl3+3H2O;复分解反应

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案【题目】工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:

已知相关物质的溶解度(20℃)如下表:
物质 | K2CO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 11.1 | 6.34 |
(1)KMnO4中锰元素的化合价为_____.
(2)操作I的名称是_____.“干燥”过程中温度不宜过高的原因是_____(用化学方程式表示).
(3)“通CO2酸化”,反应的化学方程式为:3K2 MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;不用稀H2SO4酸化,反应的化学方程式为:3K2 MNO4+2H2SO4═2KMnO4+MnO2↓+2K2SO4+2H2O;工业上不采用稀H2SO4酸化的原因是_____.
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为:2K2 MnO4+2H2O![]() 2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.
2KMnO4+2KOH+H2↑,与“通CO2酸化”相比,其优点是_____.