题目内容
24、某化学学习小组同学设计了如下学习思路,从微观角度进一步理解某些复分解反应的实质.
【练习】写出下列复分解反应的化学方程式.
(1)氢氧化钠溶液与稀硫酸混合:
(2)碳酸钠溶液与足量盐酸混合:
【质疑】从微观角度思考,上述复分解反应的实质是什么?
【讨论】反应(1)的实质是H+和OH-结合生成水;反应(2)的实质是
应用】请在H+、Ba2+、NH4+这三种离子中选择合适的离子填入下图,形成一个复分解反应网络(图中直线相连的阴、阳离子之间能够两两结合发生反应).

【练习】写出下列复分解反应的化学方程式.
(1)氢氧化钠溶液与稀硫酸混合:
2NaOH+H2SO4═Na2SO4+2H2O
.(2)碳酸钠溶液与足量盐酸混合:
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.【质疑】从微观角度思考,上述复分解反应的实质是什么?
【讨论】反应(1)的实质是H+和OH-结合生成水;反应(2)的实质是
CO32-和H+结合生成CO2和H2O
.小结】阴、阳离子结合生成沉淀
、气体
或水,是某些复分解反应的实质.应用】请在H+、Ba2+、NH4+这三种离子中选择合适的离子填入下图,形成一个复分解反应网络(图中直线相连的阴、阳离子之间能够两两结合发生反应).

分析:【练习】①氢氧化钠和硫酸发生中和反应生成硫酸钠和水;②碳酸钠与硫酸反应生成硫酸钠、水、放出二氧化碳;
【讨论】反应②中氢离子与碳酸根离子形成水和气体二氧化碳,使反应满足有水或气体生成的复分解反应发生的条件;
【小结】根据反应的化学方程式及分析可以得出复分解反应的发生条件;
【应用】利用离子间的反应关系:生成沉淀、气体或水即可发生反应,推断H+、Ca2+、NH4+三种离子在反应网络中的位置.
【讨论】反应②中氢离子与碳酸根离子形成水和气体二氧化碳,使反应满足有水或气体生成的复分解反应发生的条件;
【小结】根据反应的化学方程式及分析可以得出复分解反应的发生条件;
【应用】利用离子间的反应关系:生成沉淀、气体或水即可发生反应,推断H+、Ca2+、NH4+三种离子在反应网络中的位置.
解答:解:【练习】①氢氧化钠溶液与硫酸混合,通过交换成分,生成硫酸钠和水;
②碳酸钠溶液与硫酸混合,通过交换成分生成硫酸钠和碳酸,碳酸易分解,生成物中的碳酸要写成水和二氧化碳;
【讨论】根据反应①②的分析,反应物中含有特殊的阴、阳离子即能形成水、气体或沉淀的两种离子;
【小结】根据所写的化学方程式结合所学的其他反应可以判断复分解反应发生的条件为必须有气体沉淀或水生成;
[【应用】根据复分解反应发生的条件可以知道:短线相连的这些阴、阳离子两两结合应该沉淀或气体或水,在所给的H+、Ba2+、NH4+三种离子中既能与OH-又能与CO32-形成沉淀或气体或水的离子为H+,在Ba2+、NH4+两种离子中NH4+能与OH-形成气体、而Ba2+能与CO32-形成沉淀;
故答案为:
(1)2NaOH+H2SO4═Na2SO4+2H2O;
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【讨论】CO32-和H+结合生成CO2和H2O;
【小结】沉淀;气体;
【应用】NH4+;H+;Ba2+
②碳酸钠溶液与硫酸混合,通过交换成分生成硫酸钠和碳酸,碳酸易分解,生成物中的碳酸要写成水和二氧化碳;
【讨论】根据反应①②的分析,反应物中含有特殊的阴、阳离子即能形成水、气体或沉淀的两种离子;
【小结】根据所写的化学方程式结合所学的其他反应可以判断复分解反应发生的条件为必须有气体沉淀或水生成;
[【应用】根据复分解反应发生的条件可以知道:短线相连的这些阴、阳离子两两结合应该沉淀或气体或水,在所给的H+、Ba2+、NH4+三种离子中既能与OH-又能与CO32-形成沉淀或气体或水的离子为H+,在Ba2+、NH4+两种离子中NH4+能与OH-形成气体、而Ba2+能与CO32-形成沉淀;
故答案为:
(1)2NaOH+H2SO4═Na2SO4+2H2O;
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【讨论】CO32-和H+结合生成CO2和H2O;
【小结】沉淀;气体;
【应用】NH4+;H+;Ba2+
点评:复分解反应的实质就是溶液中离子间的反应,溶液中离子间能形成沉淀或气体或水,复分解反应就能发生.

练习册系列答案
相关题目
 海洋资源十分丰富.
海洋资源十分丰富.(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、
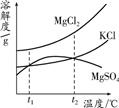
(2)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,
如图是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小
关系为
(3)目前世界上60%的镁是从海水中提取的.其主要步骤如下:
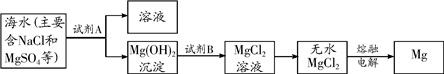
①提取Mg的过程中,试剂B选用
由无水MgCl2制取Mg的化学反应方程式为
在此过程中
②镁是重要的金属材料,广泛应用于合金、火箭和飞机制造业.镁是一种较活泼金属,在二氧化碳气体中也能燃烧.燃烧的化学方程式为:2Mg+C02═C+2MgO,反应类型属于
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为-3.据此写出该反应的化学方程式
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
③分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了
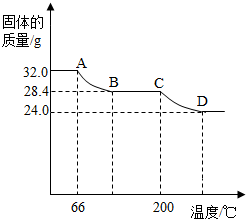
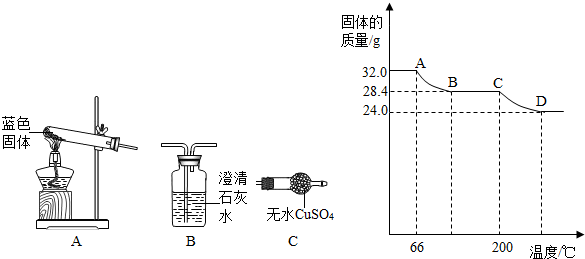
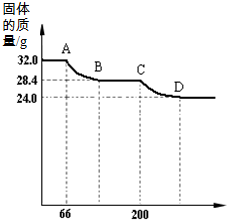 绘成固体质量变化与分解温度的关系如图,
绘成固体质量变化与分解温度的关系如图,