题目内容
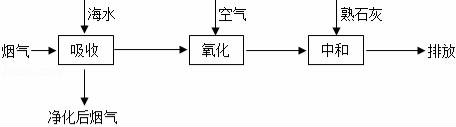
【题目】金属铜和浓硝酸、稀硝酸反应的方程式如下:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释.试简答:
(1)用稀硝酸而不用浓硝酸的原因:
(2)从经济效益和环保角度考虑、设计制取硝酸铜的最适宜方法,用化学方程式表示为: .
【答案】(1)制备等质量的硝酸铜时消耗的稀硝酸比浓硝酸少.
(2)2Cu+O2![]() 2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
【解析】解:(1)由反应的化学方程式可知,制备等质量的硝酸铜时消耗的稀硝酸比浓硝酸少,因此在实际生产中,用稀硝酸而不用浓硝酸.
故填:制备等质量的硝酸铜时消耗的稀硝酸比浓硝酸少.
(2)从经济效益和环保角度考虑、制取硝酸铜的最适宜方法是:加热条件下,铜和氧气反应生成氧化铜,再利用稀硝酸溶解氧化铜,稀硝酸和氧化铜反应生成硝酸铜和水,反应的化学方程式分别是:
2Cu+O2![]() 2CuO、CuO+2HNO3=Cu(NO3)2+H2O.
2CuO、CuO+2HNO3=Cu(NO3)2+H2O.
故填:2Cu+O2![]() 2CuO,CuO+2HNO3=Cu(NO3)2+H2O.
2CuO,CuO+2HNO3=Cu(NO3)2+H2O.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
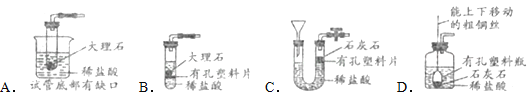
小学生10分钟应用题系列答案【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
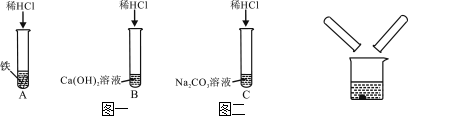
(1)A试管中的反应现象是 。
(2)C试管中反应的化学方程式是 。
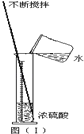
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:有NaCl
乙同学猜想:有NaCl、CaCl2
丙同学猜想:有NaCl、CaCl2、 HCl
你的猜想:有 。
【交流讨论】
你认为 同学的猜想一定不正确,理由是 。
【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 。 | _________________。 | 我的猜想成立 |
【反思与总结】判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑 。