题目内容
【题目】硫酸亚铁是一种重要的食品和饲料添加剂,某补血剂样品【主要成分为硫酸亚铁晶体(FeSO4xH2O)】,某化学兴趣小组对其产生了兴趣并进行了探究:
【探究一】硫酸亚铁晶体(FeSO4xH2O)热分解研究
【查阅资料】
1.无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体;
2.硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
3.二氧化硫能使高锰酸钾溶液褪色。
【进行实验】该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行分析,并利用SDTQ600热分析仪,对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示的关系图,试回答:
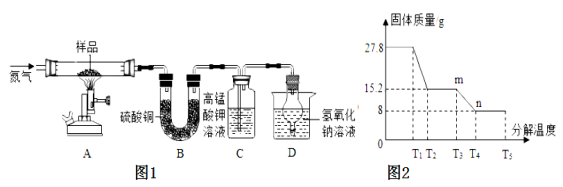
(1)装置B中硫酸铜粉末变蓝,说明产物中有 ,该物质的质量是 g;装置C中高锰酸钾溶液褪色,说明产物中还有 ;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为 。
(2)D装置中球形干燥管的作用是 。
(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,请写出化学反应方程式 。
(4)根据图2中的数据,请求出FeSO4xH2O中的x= 。(不写过程)
【交流讨论】实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
【探究二】补血剂样品中硫酸亚铁的含量:
①取10g补血剂样品研细后溶于40g水中,研细的目的是 ;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g。
请计算出10g样品中FeSO4的质量分数,写出计算过程。此题2分。
(已知:FeSO4+BaCl2=BaSO4↓+FeCl2,有关相对分子质量:FeSO4—152,BaSO4—233)
【答案】【探究一】(1)水,12.6g;SO2;Fe2O3+6HCl=2FeCl3+3H2O。(2)防止NaOH溶液倒吸。
(3)2FeSO4=Fe2O3+SO2↑+SO3↑(4)x=7【交流讨论】偏小【探究二】增大接触面积,使其充分溶解;45.6%
【解析】
试题分析:装置B中硫酸铜粉末变蓝,说明产物中有水,硫酸铜粉末遇到水后会变为蓝色,图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.该物质的质量是12.6g;装置C中高锰酸钾溶液褪色,说明产物中还有SO2;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O。D装置中球形干燥管的作用是防止NaOH溶液倒吸。硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,化学反应方程式2FeSO4=Fe2O3+SO2↑+SO3↑。图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.生成的氧化铁的质量是8g.通过FeSO4?xH2O的化学式可知铁原子和水的个数比为1:x
Fe2O3~2xH2O
160 36x
8g 12.6g
列比例式得:160:8克=36X:12.6克 解得:x=7
实验中要持续通入氮气,将生成的水蒸气全部排出,否则测出的x值会偏小;
取10g补血剂样品研细后溶于40g水中,研细的目的是:增大接触面积,使其充分溶解;
设样品中FeSO4的质量分数为X
FeSO4+BaCl2=BaSO4↓+FeCl2
152 233
10 X克 6.99克 列比例式得:152:10X克=233:6.99克 解得X=45.6%。

【题目】

请写出该中和反应方程式: .
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学: .
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是: .
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比. | pH 7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
猜想三:成立 |