题目内容
【题目】实验室用一氧化碳还原氧化铜的装置如图所示,试回答下列问题:
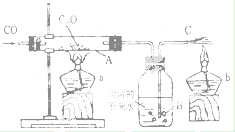
(1)在加热氧化铜前需先通一会儿一氧化碳, 这是为了 。
(2)在A处观察到的现象是 _____________________ ,反应的化学方程式是 ;
在B处观察到的现象是 ,说明A处有 ___________生成。
(3)在C处观察的现象是 ,点燃尾气的目的是
反应的化学方程式是 。
(4)以上装置验证了一氧化碳的 性和 性。
【答案】(1)排除装置中的空气,防止加热时CO与O2混合发生爆炸
(2)黑色粉末变红 CO+ CuO![]() Cu + CO2 澄清石灰水变浑浊 CO2
Cu + CO2 澄清石灰水变浑浊 CO2
(3)有蓝色火焰产生 防止空气污染 2CO + O2 ![]() 2CO2
2CO2
(4)还原性 可燃性。
【解析】
试题分析:(1)该装置中有空气,为了CO中混有空气,所以要先通入一氧化碳一会儿以便把装置中的空气赶净,防止加热时CO与O2混合发生爆炸
(2)黑色的氧化铜在高温条件下可以被一氧化碳还原为红色的铜;二氧化碳能使澄清石灰水变浑浊;故方程式为CO+ CuO![]() Cu + CO2
Cu + CO2
(3)一氧化碳有毒,为防止污染大气,所以可以用燃烧的方法将其处理掉,一氧化碳燃烧时发出蓝色火焰;故方程式为2CO + O2 ![]() 2CO2
2CO2
一氧化碳可以燃烧,证明一氧化碳有可燃性;一氧化碳可以把氧化铜还原为铜,证明一氧化碳有还原性;

练习册系列答案
相关题目