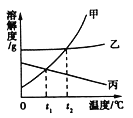
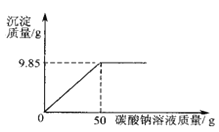
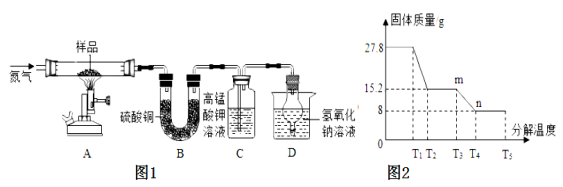
题目内容
【题目】根据下列实验装置图,回答有关问题。
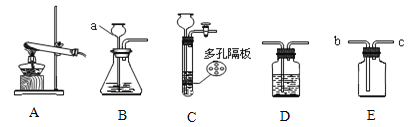
(1)写出有关标号仪器的名称a
(2)若实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,应选用的发生装置是 ,该反应的化学方程式是 。实验室用B装置制取干燥的氧气,还应选用D装置,并在该装置中盛放 (填试剂的名称)。
(3)若用C来制取二氧化碳,则多孔隔板上应该放 (填药品的名称),请写出实验室制取二氧化碳的化学方程式 ,若用E装置收集二氧化碳,则检验二氧化碳已经收集满的方法是 。
(4)老师为同学们做如下实验:A装置的集气瓶中装有体积比约为1∶1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量的铁钉;D装置中盛有足量的稀硫酸。
实验步骤如下:关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A中后溶液变为蓝色,B中长导管脱离液面。一段时间后,再打开K2,观察到D中液体进入C中。请回答:
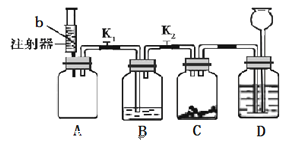
若a气体是二氧化碳,则b是 溶液(填化学式);
若b是水,则气体a可能是 (填化学式)。
装置C中发生的化学反应的方程式为 。
【答案】(1)长颈漏斗(2)A,2KClO3![]() 2KCl+3O2↑。浓硫酸。(3)大理石或石灰石,CaCO3+2HCl=CaCl2+H2O+CO2↑。将燃着的木条放在C导管口,若熄灭,则满了(4)NaOH溶液;NH3Fe+H2SO4=FeSO4+H2↑
2KCl+3O2↑。浓硫酸。(3)大理石或石灰石,CaCO3+2HCl=CaCl2+H2O+CO2↑。将燃着的木条放在C导管口,若熄灭,则满了(4)NaOH溶液;NH3Fe+H2SO4=FeSO4+H2↑
【解析】
试题分析:若实验室用加热氯酸钾和二氧化锰混合物的方法制取氧气,应选用的发生装置是A,因为过程中需要加热,该反应的化学方程式是2KClO3![]() 2KCl+3O2↑。实验室用B装置制取干燥的氧气,还应选用D装置,并在该装置中盛放浓硫酸,利用浓硫酸的吸水性来干燥气体。若用C来制取二氧化碳,则多孔隔板上应该放大理石或者石灰石,实验室制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,若用E装置收集二氧化碳,则检验二氧化碳已经收集满的方法是将燃着的木条放在C导管口,若熄灭,则满了。老师为同学们做如下实验:A装置的集气瓶中装有体积比约为1∶1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量的铁钉;D装置中盛有足量的稀硫酸。
2KCl+3O2↑。实验室用B装置制取干燥的氧气,还应选用D装置,并在该装置中盛放浓硫酸,利用浓硫酸的吸水性来干燥气体。若用C来制取二氧化碳,则多孔隔板上应该放大理石或者石灰石,实验室制取二氧化碳的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑,若用E装置收集二氧化碳,则检验二氧化碳已经收集满的方法是将燃着的木条放在C导管口,若熄灭,则满了。老师为同学们做如下实验:A装置的集气瓶中装有体积比约为1∶1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量的铁钉;D装置中盛有足量的稀硫酸。
实验步骤如下:关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A中后溶液变为蓝色,说明A中的气压变小,B中长导管脱离液面。一段时间后,再打开K2,观察到D中液体进入C中。若a气体是二氧化碳,则b是氢氧化钠溶液,因为氢氧化钠会和二氧化碳反应,使得瓶内的气压变小;[若b是水,则气体a可能是氨气,因为氨气极易溶于水中,组成A中的气压变小。装置D中的液体会流入C中,装置C中发生的化学反应的方程式为Fe+H2SO4=FeSO4+H2↑。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案