题目内容
【题目】将二氧化碳气体通入澄清石灰水溶液中,会看到澄清石灰水_____,发生反应的化学方程式为_____。若继续通入二氧化碳至过量,会进一步与碳酸钙、水反应生成易溶于水的碳酸氢钙(CaCO3+H2O+CO2═Ca(HCO3)2),现向含有25.6g Ca(OH)2的澄清石灰水里缓缓通入一定量的二氧化碳,反应后若生成20g沉淀,则通入CO2的质量可能为_____。
【答案】变浑浊 Ca(OH)2+CO2═CaCO3↓+H2O 8.8g或21.6g
【解析】
将二氧化碳气体通入澄清石灰水溶液中,二氧化碳与澄清石灰水中的氢氧化钙反应生成碳酸钙沉淀,会看到澄清石灰水变浑浊,,故填变浑浊;
二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,故反应的化学方程式写为:Ca(OH)2+CO2═CaCO3↓+H2O;
设二氧化碳不足时通入二氧化碳质量为x,
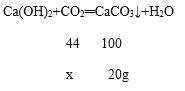
44:100=x:20g
x=8.8g
设25.6g氢氧化钙和二氧化碳恰好完全反应时消耗二氧化碳质量为z,生成碳酸钙质量为m
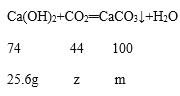
74:44=25.6g:z z=15.2g
74:100=25.6g:m m=34.6g
设溶解14.6g碳酸钙需要二氧化碳质量为y,
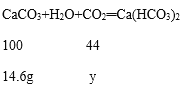
100:44=14.6g:y
y=6.4g
则二氧化碳过量时需要二氧化碳质量为:15.2g+6.4g=21.6g
则通入CO2的质量可能是8.8g,也可能是21.6g,故填8.8g或21.6g。

练习册系列答案
相关题目