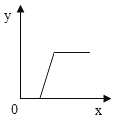��Ŀ����
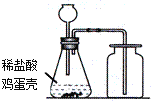
����Ŀ��ij��ȤС��ͬѧȥ�γ��ιۣ������˲��ִ�����Ʒ�����������������̽����
��1����������������_____��
��2�������������У���_____ʱ��ֹͣ���ȣ��������Ƚ���Һ���ɡ�
��3�����ᴿ�õ��ġ����Ρ�����100g 5%���Ȼ�����Һ������⣬������������ƫС����ԭ�������_____��ѡ��һ��ԭ��
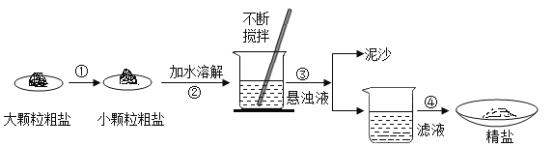
��4�������г���������ɳ�Ȳ����������⣬�����������Ŀ��������ʣ�Ϊ�˵õ��ϴ������Ȼ��ƣ�С��ͬѧ�����õġ����Ρ����������´������ٶ�����������ֻ��MgCl2һ�֣���
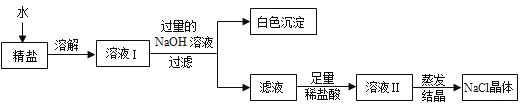
������ҺI�м������NaOH��Һ��Ŀ����_____���û�ѧ����ʽ��ʾ����
����Һ���к��е�������_____�������ӷ��ţ���
������������ģ����յõ���NaCl�����������_____������ڡ�����С�ڡ����ڡ���ԭ������NaCl��������
���𰸡����� �������г��ֽ϶������� �Ȼ��Ʋ��� 2NaOH+MgCl2��2NaCl+Mg��OH��2�� Na+��Cl�� ����
��������
��1���������Ƿ��������Թ�����Һ��ķ������ǹ��˲�����������ˣ�
��2���������������ᾧ���˹����У����������г��ֽ϶�������ʱ����ֹͣ���ȣ��������Ƚ���Һ���ɣ�����������г��ֽ϶������壻
��3���Ȼ��ƹ��岻��ʱ���ᵼ���Ȼ�������ƫС���Ӷ�������Һ��������������ƫС����ȡˮʱ���Ӷ������ᵼ����ȡ��ˮƫ�࣬�Ӷ�������Һ��������������ƫС�ȣ�����Ȼ��Ʋ�����
��4���������������Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ����2NaOH+MgCl2��2NaCl+Mg��OH��2����
�����ڼ��������������Һ���������Լ���������������������������Ʒ�Ӧ�����Ȼ��ƺ�ˮ�������Һ���к����Ȼ��ƣ����е��������������������ӣ����Na+��Cl����
����ʵ������в�������ģ����ڷ�Ӧ�������Ȼ��ƣ�������յ���NaCl���������������ԭ������NaCl��������������ڡ�

 Ӣ��СӢ������Ĭдϵ�д�
Ӣ��СӢ������Ĭдϵ�д� �����ҵ���������ͯ������ϵ�д�
�����ҵ���������ͯ������ϵ�д�