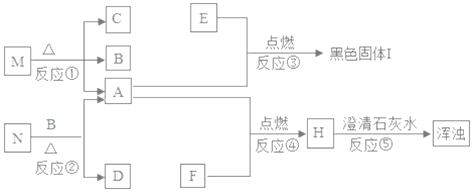
题目内容
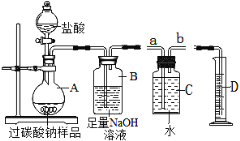
【题目】“盐巴”即食盐,因古代巴人熬制并垄断其销售而得名。他们从盐井中获得粗盐(含泥沙、Na2SO4和CaCl2等杂质),然后经多次处理最终得到盐巴”.
某课外小组同学根据所学知识准备把粗盐提纯成不含杂质的精盐。其主要步骤为:
(一)除不溶性杂质
除不溶性杂质的主要步骤为:溶解、______(填操作名称)、蒸发和计算产率.
在操作过程中必需用到的玻璃仪器为:酒精灯、玻璃棒、烧杯和_______(填名称)。
(二)除可溶性杂质
他们称取上步产品5g,充分溶于水按下面流程进行提纯:
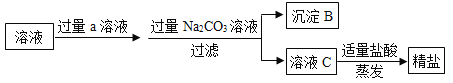
(1)物质a不能选用______(填序号)。
A. Ba(NO3)2 B. Ba(OH)2 C. BaCl2
(2)沉淀B是碳酸钙和______(填名称)。过程中两次加入过量试剂的主要目的是_______.
(3)若上述操作都正确无误,最后得到精盐的质量为6g比原来的质量还要多,请简要分析其主要原因_____________________.
【答案】过滤 漏斗 A 硫酸钡、碳酸钡 将硫酸钠、氯化钙完全除去 除杂过程中会生成氯化钠
【解析】
(一)根据粗盐提纯的步骤有:溶解、过滤、蒸发、和计算产率,在操作过程中必需用到的玻璃仪器为:酒精灯、玻璃棒、烧杯和漏斗进行分析;
(二)(1)根据硝酸钡和硫酸钠反应生成的硝酸钠对于氯化钠来说仍是杂质进行分析;
(2)根据钡离子和硫酸根离子反应生成硫酸钡沉淀,碳酸根离子和钙离子、钡离子生成碳酸钡沉淀和碳酸钙沉淀进行分析;
(3)根据硫酸钠和氯化钡反应生成氯化钠和硫酸钡沉淀、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,除杂时都生成了氯化钠,所以反应后得到的精盐质量大于样品中氯化钠的质量进行分析。
(一)粗盐提纯的步骤有:溶解、过滤、蒸发、和计算产率,在操作过程中必需用到的玻璃仪器为:酒精灯、玻璃棒、烧杯和漏斗;
(二)(1)硝酸钡和硫酸钠反应生成的硝酸钠对于氯化钠来说仍是杂质,所以物质a不能选用a;
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀,碳酸根离子和钙离子、钡离子生成碳酸钡沉淀和碳酸钙沉淀,所以沉淀B是碳酸钙和硫酸钡、碳酸钡,过程中两次加入过量试剂的主要目的是:将硫酸钠、氯化钙完全除去;
(3)硫酸钠和氯化钡反应生成氯化钠和硫酸钡沉淀、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,除杂时都生成了氯化钠,所以反应后得到的精盐质量大于样品中氯化钠的质量。

【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
(查阅资料) ①人呼出的气体中主要成分是N2.O2.CO2和水蒸气等。
②CO2 + 2NaOH = Na2CO2 + H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)
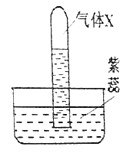
实验 Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如图1所示。
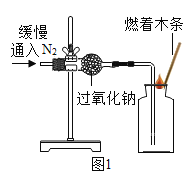
(2)实验现象及结论:观察到_________ 现象 ,判断过氧化钠与氮气没有发生反应。
实验 Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
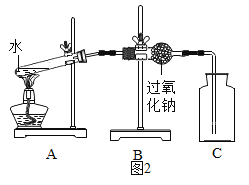
(1)同学们在老师的指导下设计了如图2所示装置。其中A装置的作用是________,发生的变化是______变化。
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验 Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如图3所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)
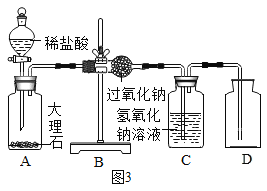
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸 | A装置中观察到的现象有_____,C装置中有气泡出现。 | A装置中发生反应的化学方程式为____; |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是________(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是____________________。
【题目】元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请回答下列问题:
1H | 2He | ||||||
3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)元素周期表中不同种元素最本质的区别是______(填字母)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
(2)镁元素的原子结构示意图为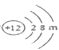 ,则m=______,该原子在化学反应中易______(填“得到”或“失去”)电子,说明元素的化学性质与原子的______关系密切。
,则m=______,该原子在化学反应中易______(填“得到”或“失去”)电子,说明元素的化学性质与原子的______关系密切。