题目内容
【题目】某兴趣小组同学用大理石和盐酸反应制取二氧化碳,将制得的气体通入澄清石灰水,观察到石灰水未变浑浊,他们对此现象产生了好奇。请你与他们一同探究:
(提出问题)为什么石灰水未浑浊?
(猜想假设)猜想①:石灰水已变质;
猜想②:制得的气体中无二氧化碳:
猜想③:_____。
(实验验证)(1)同学们为验证假设是否成立。他们将适量的原试剂瓶中的澄清石灰水倒入小试管中,然后_____(填写实验操作过程),他们根据实验现象确认了石灰水未变质。他们接着探究,通过实验又否定了猜想②。
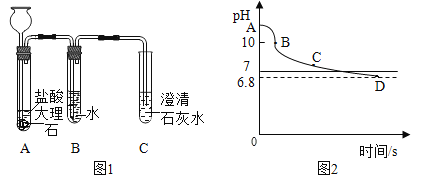
(2)同学们继续设计了如图1实验来探究猜想③:
①如图1,加入B装置后,C中澄清石灰水变浑浊。同学们通过实验确定了澄清石灰水未变浑浊的原因是二氧化碳中含有氯化氢气体,故猜想③正确。请用化学反应方程式解释将制得的气体通入澄清石灰水后,石灰水不变浑浊的原因_____。
②B装置的作用是_____,实验后向B中滴入石蕊溶液,可看到的现象是_____,写出B中主要溶质的化学式:_____。
(3)小组同学pH传感器测得纯净二氧化碳通入澄清石灰水中pH的变化曲线。如图2所示,已知BC段反应生成的是可溶于水的碳酸氢钙的过程。请你回答:①A点溶液的pH约为_____,AB段pH下降较快的原因是_____(用化学方程式表示)
②D点溶液中的溶质化学式为:_____。
【答案】可能是二氧化碳中的氯化氢气体导致石灰水不浑浊 用导管向澄清石灰水中吹气(或滴加酚酞溶液变红等合理答案也可) 2HCl+Ca(OH)2=CaCl2+2H2O 吸收氯化氢气体 紫色石蕊溶液变红 HCl(填HCl、H2CO3或HCl、H2CO3、CO2,也给分,但是没有HCl不给分) 填12或14 CO2+Ca(OH)2=CaCO3↓+H2O Ca(HCO3)2、H2CO3;或填H2CO3给分,但是只填Ca(HCO3) 2不给分
【解析】
根据浓盐酸具有挥发性分析;
[实验验证]
(1)根据氢氧化钙遇二氧化碳变浑浊,遇无色酚酞变红色分析;
(2)①根据稀盐酸和氢氧化钙反应生成氯化钙和水分析;
②根据氯化氢气体易溶于水,酸与紫色石蕊变红色分析;
(3)根据A点的pH大于10,二氧化碳和氢氧化钙反应生成碳酸钙和水分析;
(1)浓盐酸具有挥发性,使得制取的二氧化碳中含有氯化氢气体,导致石灰水不变浑浊。
(2)石灰水没有变质,说明溶液中含有氢氧化钙,可以用导管向澄清石灰水中吹气进行验证,也可以向石灰水中滴加无色酚酞溶液,因为有氢氧化钙,所以溶液会变红色的;
(3)①澄清石灰水未变浑浊的原因是二氧化碳中含有氯化氢气体,氯化氢气体溶于水形成盐酸,盐酸和氢氧化钙反应生成氯化钙和水,方程式是2HCl+Ca(OH)2=CaCl2+2H2O;
②氯化氢易溶于水,因此装置B的作用是吸收氯化氢气体,形成稀盐酸,因此溶液是酸性的,滴加紫色石蕊溶液后,溶液会变红色,B是氯化氢的水溶液,形成溶质是氯化氢;
(4)A点的pH 大于10,根据A点距10的距离,因此A的点的pH可以是12或14;AB段pH下降较快的原因是二氧化碳和氢氧化钙发生了反应,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;已知BC段反应生成的是可溶于水的碳酸氢钙的过程。D点的溶液呈酸性因此,溶质是Ca(HCO3)2、H2CO3;
故答案为:猜想③:可能是二氧化碳中的氯化氢气体导致石灰水不浑浊。(1)用导管向澄清石灰水中吹气(或滴加酚酞溶液变红等合理答案也可);(2)①2HCl+Ca(OH)2=CaCl2+2H2O;②吸收氯化氢气体; 紫色石蕊溶液变红;HCl(填HCl、H2CO3或HCl、H2CO3、CO2,也给分,但是没有HCl不给分)。(3)①填12或14; CO2+Ca(OH)2=CaCO3↓+H2O;②Ca(HCO3)2、H2CO3;或填H2CO3给分,但是只填Ca(HCO3) 2不给分;

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某班同学用氢氧化钠溶液和稀盐酸进行中和反应实验:
(1)甲同学实验操作如下:
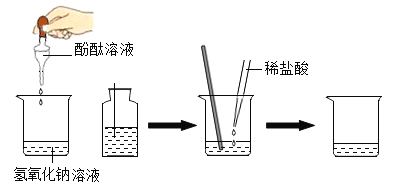
在烧杯中加入约5 mL氢氧化钠溶液、滴入几滴无色酚酞溶液,此时溶液呈________色。接着用滴管滴入一定量的稀盐酸,再用玻璃棒____________,发现溶液为无色,于是甲同学得出两者恰好中和的结论,反应的化学方程式为________________________。
(2)乙同学对甲同学的结论提出了质疑,并对反应后溶液中的溶质成分进行探究。
(实验探究)反应后溶液中的溶质是什么?
猜想一:只有NaCl
猜想二:NaCl和HCl
猜想三:NaCl和NaOH
以上猜想中,你觉得不合理的是________________。
为了验证另外两种猜想,乙同学设计如下实验方案。
实验操作 | 实验现象 | 实验结论 |
取少量反应后的溶液于试管中滴入Na2CO3溶液 | ________ | 猜想二成立 |
(反思交流)实验结束后,废液处理方法正确的是______(填序号)。
A 倒入下水道 B 倒入废液缸 C 带出实验室
(拓展延伸)乙同学再设计一个验证猜想二的实验:取少量反应后的溶液于试管中加入少量氧化铜粉末,若________________________,猜想二成立。
(3)用溶质质量分数为5%的NaOH溶液完全中和73 g10%的稀盐酸,需NaOH溶液多少克________?
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_______和氢氧化钙。此过程的化学方程式_______。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe ,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | ________ | 固体中一定含有CaCO3 |
[交流与反思]
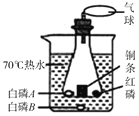
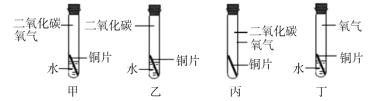
(1)“504双吸剂”中的铁粉可以吸收空气中的_______、______。
(2)实验操作(2)的实验现象里“有大量无色气体产生”, 根据甲同学的整体探究方案推测,无色气体的成分是一定含有______,可能含有________。
(3)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是______。
(4)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_______。