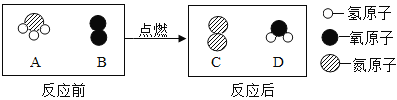
题目内容
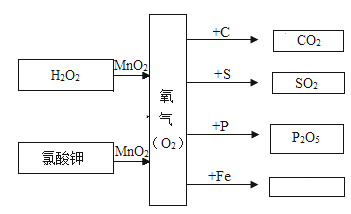
【题目】某学习小组的同学对过氧化氢分解进行探究。
I.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量 | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”“二”或“<”)。
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_________(填实验序号),合理的结论是______。
(交流探讨)MnO2属于金属氧化物,其他金属氧化物能否起到类似MnO2的催化作用?
II.[探究二]探究FerOs是否对过氧化氢分解起催化作用。
操作步骤 | 实验情况记录 | 结论 | |
(1) |
| A试管上方带火星的木条未复燃,B中出现气泡快,带火星的木条复燃现象 | Fe2O3________(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
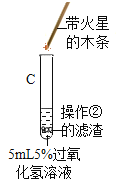
(2) | 将B试管中的混合物_________,把得到固体烘干、称量。 | 固体质量为0.2 g | Fe2O3质量未变 |
(3) |
| C试管上方带火星的木条________。 | Fe2O3化学性质未变 |
(得出结论)Fe2O3能对过氧化氢的分解起催化作用。
【答案】> ③④ 其他条件相同时,过氧化氢的浓度越大,过氧化氢分解越快 加快 过滤 复燃
【解析】
[探究一]
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,反应所需时间越短,则t1>t2。
(2)实验③④的温度和二氧化锰的用量都相同,只有过氧化氢溶液的浓度不同,导致反应时间不同,所以能说明过氧化氢分解快慢与溶质质量分数有关的实验是,合理的结论是:其他条件相同时,过氧化氢的浓度越大,过氧化氢分解越快。
[探究二]
(1)根据A试管上方带火星的木条未复燃,B中出现气泡快,带火星的木条复燃,说明氧化铁能加快过氧化氢分解;
(2)根据氧化铁质量未变可知操作是将B试管中的混合物过滤,把得到固体烘干、称量,目的是验证反应前后氧化铁的质量是否改变;
(3)因为Fe2O3可作过氧化氢分解的催化剂,实验操作是验证反应前后氧化铁的化学性质是否改变,根据实验结论Fe2O3化学性质未变,即能加快过氧化氢的分解,可知C试管上方带火星的木条复燃。