题目内容
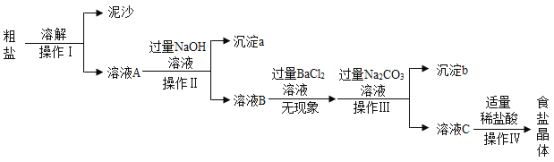
【题目】某化学课外小组同学设计了五个实验探究质量守恒定律,实验操作如下图:
A B
B C
C D
D E
E
(1)实验观察到A、C、E实验前后天平依然保持平衡,某同学认为A、C、E实验都能验证质量守恒定律,你认为他的说法是______(填“正确”或“不正确”)的,而B、D实验天平不平衡,其中D实验天平不平衡的原因是______。
(2)小组同学得出结论:探究质量守恒定律,如果选择B、D实验中的药品,实验装置必须______。
(3)下图是同学们绘制的某反应微观示意图,请写出该反应的化学方程式:______。

(4)分析以上微观过程示意图,从宏观和微观两个方面能得到的信息是(各写一条):
宏观:______;
微观:______。
【答案】不正确 装置没有密封,增加了氧气的质量,生成的氧化镁部分散失到空气中 密封(或密闭)  化学反应前后,元素的种类不变 化学反应前后,原子的种类、数目不变
化学反应前后,元素的种类不变 化学反应前后,原子的种类、数目不变
【解析】
(1)E实验中,氯化钠溶于水没有发生化学反应,不能用质量守恒定律解释;D实验天平不平衡的原因是装置没有密封,增加了氧气的质量,生成的氧化镁部分散失到空气中;
(2)有气体参加或生成的反应在验证质量守恒定律时应在密闭容器中进行;
(3)根据微观示意图可知,该反应是二氧化碳与氧气在高温和催化剂条件下生成三氧化硫,反应的化学方程式为: ;
;
(4)分析以上微观过程示意图,从宏观和微观两个方面能得到的信息是:
宏观:化学反应前后,元素的种类不变;
微观:化学反应前后,原子的种类、数目不变。

【题目】某学习小组的同学对过氧化氢分解进行探究。
I.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量 | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”“二”或“<”)。
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_________(填实验序号),合理的结论是______。
(交流探讨)MnO2属于金属氧化物,其他金属氧化物能否起到类似MnO2的催化作用?
II.[探究二]探究FerOs是否对过氧化氢分解起催化作用。
操作步骤 | 实验情况记录 | 结论 | |
(1) |
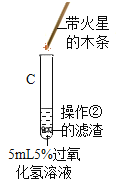
| A试管上方带火星的木条未复燃,B中出现气泡快,带火星的木条复燃现象 | Fe2O3________(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
(2) | 将B试管中的混合物_________,把得到固体烘干、称量。 | 固体质量为0.2 g | Fe2O3质量未变 |
(3) |
| C试管上方带火星的木条________。 | Fe2O3化学性质未变 |
(得出结论)Fe2O3能对过氧化氢的分解起催化作用。