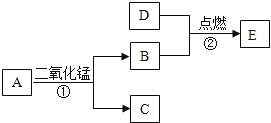
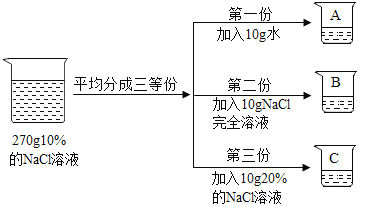
题目内容
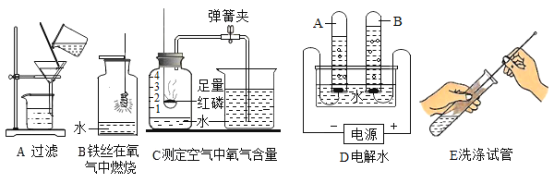
【题目】根据下列实验装置图填空:

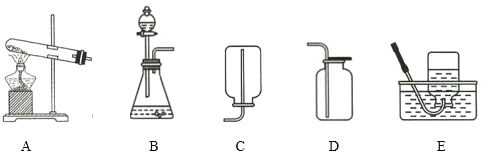
(1)图中标有序号仪器的名称:①_________②_________
(2)制取气体时,组装好仪器后,应先____________,再添加药品;给装置A试管里的固体物质加热时,应先________,然后集中加热盛有药品的部位。
(3)实验室用过氧化氢溶液和二氧化锰制氧气时,应选用发生装置是______(选填装置序号),反应的化学方程式___________。
(4)实验室制备气体时,选择气体发生装置,应考虑的因素是_________和_________。
(5)通常情况下,二氧化碳是一种无色无味能溶于水,密度比空气大的气体,实验室常用块状的石灰石和稀盐酸在常温下反应制备二氧化碳,应选择的发生装置是______(选填装置序号),收集装置是_____(选填装置序号)
【答案】分液漏斗 水槽 检查装置的气密性 预热 B 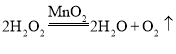 反应物的状态 反应条件 B C
反应物的状态 反应条件 B C
【解析】
实验室制取气体发生装置的选择主要看反应物的状态(固态还是液态)和反应条件(是否需要加热),将发生装置分为固体加热型装置和固液混合不加热型装置;收集装置主要根据生成气体在水中的溶解性以及是否和水反应考虑能否用排水法,不易溶于水或不溶于水且不与水发生反应可以采用排水法收集,还可以根据气体和空气密度的比较以及是否和空气中的各成分反应,判断能否采用排空气法收集,如果气体密度和空气密度非常接近则不适宜采用排空气法,在使用排空气法收集时,密度比空气大的采用向上排空气法,密度比空气小的采用向下排空气法收集。
(1)图中①的名称是分液漏斗;②的名称是水槽;
(2)制取气体时,组装好仪器后,应先检查装置的气密性,再添加药品;给装置A试管里的固体物质加热时,应先预热,然后集中加热盛有药品的部位,防止受热不均试管炸裂;
(3)实验室用过氧化氢溶液和二氧化锰制氧气时,反应物是固液混合,反应条件不需要加热,应选用固液混合不加热型的发生装置B;过氧化氢在二氧化锰的催化下,生成氧气和水,反应的化学方程式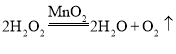 ;
;
(4)由分析可知,实验室制备气体时,选择气体发生装置,应考虑的因素是反应物的状态和反应条件;
(5)块状的石灰石是固体,稀盐酸是液体,反应在常温下进行,应选择的发生装置是B;二氧化碳能溶于水,密度比空气大,不能使用排水法收集,应使用向上排空气法收集,收集装置是C。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案【题目】某学习小组的同学对过氧化氢分解进行探究。
I.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量 | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”“二”或“<”)。
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_________(填实验序号),合理的结论是______。
(交流探讨)MnO2属于金属氧化物,其他金属氧化物能否起到类似MnO2的催化作用?
II.[探究二]探究FerOs是否对过氧化氢分解起催化作用。
操作步骤 | 实验情况记录 | 结论 | |
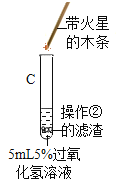
(1) |
| A试管上方带火星的木条未复燃,B中出现气泡快,带火星的木条复燃现象 | Fe2O3________(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
(2) | 将B试管中的混合物_________,把得到固体烘干、称量。 | 固体质量为0.2 g | Fe2O3质量未变 |
(3) |
| C试管上方带火星的木条________。 | Fe2O3化学性质未变 |
(得出结论)Fe2O3能对过氧化氢的分解起催化作用。