题目内容
【题目】某同学进行下图两个实验。
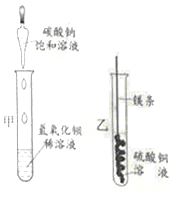
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。
【答案】(l)2NaHCO3+Ba(OH)2=BaCO3↓+2H2O+Na2CO3;(2)镁的表面有红色固体生成。(3)氢氧化镁; Mg(OH)2+ +2HCl== MgCl2+2H2O;②沉淀部分溶解③且有气体产生【拓展与思考】碳酸钠溶液过量;碳酸钠和氢氧化镁不共存。
【解析】(l)碳酸氢钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式为2NaHCO3+Ba(OH)2=BaCO3↓+2H2O+Na2CO3;(2)镁的活动性比铜的强,镁能与硫酸铜溶液反应生成硫酸镁和铜,观察到的现象是溶液由蓝色变为无色,镁的表面有红色固体生成。(3)硫酸钡和氢氧化镁能生成氢氧化镁和硫酸钡白色沉淀,碳酸钠和硫酸镁能生成碳酸镁白色沉淀;甲试管中一定有氢氧化钠,乙试管的溶液中一定有硫酸镁,所以硫酸镁一定存在,所以沉淀可能是由氢氧化镁。①若沉淀全部溶解,且无其它现象;则沉淀只有氢氧化镁;其化学反应方程式为Mg(OH)2+ +2HCl== MgCl2+2H2O;②硫酸钡不溶于酸。若沉淀部分溶解且无气体产生,猜想Ⅱ成立。③若沉淀完全溶解,且有气体产生,猜想Ⅲ成立。因为碳酸镁能与盐酸反应生成易溶于水的氯化镁、同时生成二氧化碳气体;【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时碳酸钠溶液过量;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是碳酸钠和氢氧化镁不共存。

 阅读快车系列答案
阅读快车系列答案