��Ŀ����
����Ŀ�������й㷺���о���Ӧ�ü�ֵ��

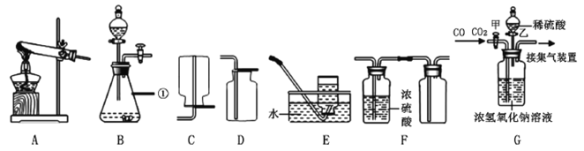
��1����ͭ�������ߣ����������õ���չ�Ժ�____________��
��2�������У����������и��õĿ���ʴ�ԣ�ԭ����_________��
��3��A����������IJ��___________��
��4��B�з�����Ӧ�Ļ�ѧ����ʽ___________��
��5����һ������AgNO3��Cu(NO3)2�Ļ����Һ�м���һ����Zn�ۣ���ַ�Ӧ����ˣ�����������Һ��
����ϴ����������μ�ϡ����������ݣ���������_______��
������Һ����ɫ������Һ�п����е�������_______���ѧʽ����
���𰸡���1�������� ��2�����ı����γ�һ�����ܵ������ﱡĤ ��3��b ��4��Fe+CuSO4=FeSO4+Cu
��5����H2�������� ��AgNO3
����������1����ͭ�������ߣ����������õ���չ�Ժ͵����ԣ�
��2�������У����������и��õĿ���ʴ�ԣ�ԭ���ǣ����ı����γ�һ�����ܵ������ﱡĤ��
��3�����������������ˮ������ͬʱ�Ӵ�����A����������IJ�λ��b��
��4����������ͭ��Ӧ����ͭ��������������B�з�����Ӧ�Ļ�ѧ����ʽΪ��Fe+CuSO4=FeSO4+Cu��
��5����п��ϡ���ᷴӦ�������������H2����������
��п������������Һ��Ӧ��������������Һ��Ӧ�꣬��������ͭ��Ӧ������Һ����ɫ����п����������Ӧ��������������ʣ�����ǡ������������ȫ��Ӧ����������ͭ��Ӧ������ͭ��ʣ�ࡣ��Һ��һ��������ͭ������п��������δ��Ӧ��������������AgNO3��

 ����������������ϵ�д�
����������������ϵ�д�����Ŀ��ijͬѧ������ͼ����ʵ�顣
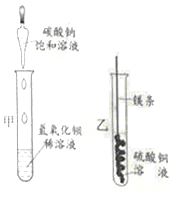
��l����ʵ���з�Ӧ�Ļ�ѧ����ʽΪ____________��
��2����ʵ��۲쵽��������___________����Һ����ɫ�����ɫ��
��3���Ѽס��ҷ�Ӧ�����Һ����ͬһ�ջ��������а�ɫ�������ɡ���������ɫ�����ijɷֽ���̽����
���������ϡ����ᱵ�������ᡣ
��������롿 ��ɫ����Ϊ����._______����.Mg(OH)2��BaSO4������Mg(OH)2��MgCO3.
��ʵ�鷽����
ʵ����� | ʵ����������� |
���ˡ�ϴ�Ӱ�ɫ�������ã����ɫ�����м������������� | ��������ȫ���ܽ⣬�����������������������仯ѧ��Ӧ����ʽΪ____________�� ����______������������������������� ����������ȫ�ܽ⣬________�������������� |
����չ��˼������������������������˽����ԭ��������ʵ��ʱ___________��������ɫ�����ijɷֲ����ܳ��ֵ������Mg(OH)2��MgCO3��BaSO4��ԭ����__________________��